1
社内資料:毒性試験「生殖発生毒性試験」(2022年3月28日承認、申請資料概要2.6.6.6)
2
社内資料:乳汁への移行(2022年3月28日承認、申請資料概要2.6.4.6.5)
3
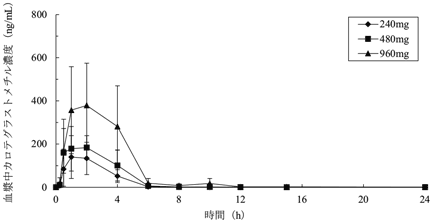
社内資料:第Ⅰ相試験結果(2022年3月28日承認、申請資料概要2.7.6.3)
4
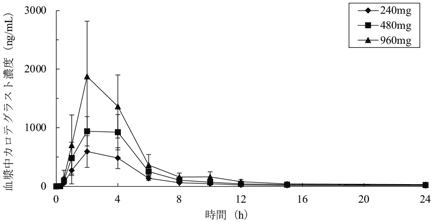
社内資料:第Ⅰ相試験結果(2022年3月28日承認、申請資料概要2.7.6.4)
5
社内資料:分布(2022年3月28日承認、申請資料概要2.6.4.4)
6
社内資料:代謝(2022年3月28日承認、申請資料概要2.6.4.5)
7
社内資料:臨床薬理試験結果(2022年3月28日承認、申請資料概要2.7.6.5)
8
社内資料:単回投与後の胆汁中排泄(2022年3月28日承認、申請資料概要2.6.4.6.3)
9
社内資料:第Ⅰ相試験結果(2022年3月28日承認、申請資料概要2.7.6.7)
10
社内資料:薬物相互作用試験(1)結果(2022年3月28日承認、申請資料概要2.7.6.8)
11
社内資料:薬物相互作用試験(2)結果(2022年3月28日承認、申請資料概要2.7.6.9)
12
社内資料:第Ⅲ相試験結果(2022年3月28日承認、申請資料概要2.7.6.14)
13
社内資料:α4インテグリンと接着分子との結合に対する阻害作用(2022年3月28日承認、申請資料概要2.6.2.2.2)
14
社内資料:α4インテグリンの生物活性に対する作用(2022年3月28日承認、申請資料概要2.6.2.2.3)
15
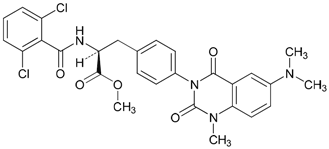
Sugiura T, et al.:J Crohns Colitis. 2013 Dec; 7(11): e533-42