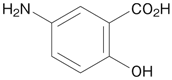
1
World MJ,et al.:Nephrol Dial Transplant. 1996;11:614-621
2
Gisbert JP,et al.:Inflamm Bowel Dis. 2007;13(5):629-638
3
Deltenre P,et al.:Gut. 1999;44:886-888
4
Braun M,et al.:Am J Gastroenterol. 1999;94:1973-1974
5
Laidlaw ST,et al.:Lancet. 1994;343:981-982
6
Turunen U,et al.:Scand J Gastroenterol. 1987;22(7):798-802
7
Klotz U,et al.:Lancet. 1993;342:618-619
8
Christensen LA,et al.:Acta Obstet Gynecol Scand. 1994;73:399-402
9
Jenss H,et al.:Am J Gastroenterol. 1990;85:331
10
de Boer NK,et al.:Am J Gastroenterol. 2007;102:2747-2753
11
Szumlanski CL,et al.: Br J Clin Pharmacol. 1995;39:456-459
12
Dewit O,et al.:Aliment Pharmacol Ther. 2002;16:79-85
13
Agnholt J,et al.:Lancet. 1989;333(8647):1135
14
Foster RA,et al.:Inflamm Bowel Dis. 2003;9(5):308-315
15
Nanayakkara PW,et al.:Eur J Intern Med. 2004;15(7):470-472
16
Ito H,et al.:Adv Ther. 2009;26(8):749-761
17
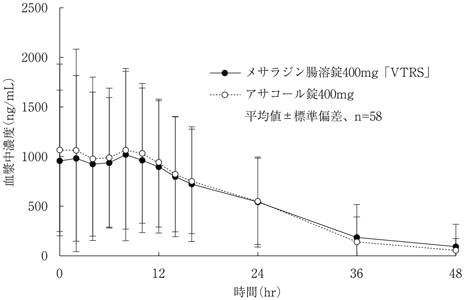
社内資料:生物学的同等性試験(メサラジン腸溶錠400mg「VTRS」)
18
Hirayama M,et al.:Mol Pharm. 2011;8(4):1083-1089
19
Ito H,et al.:Inflamm Bowel Dis. 2010;16(9):1567-1574
20
Ito H,et al.:Inflamm Bowel Dis. 2010;16(9):1575-1582
21
活動期 第Ⅲ相試験(アサコール錠:2009.10.16承認、CTD2.7.6.3)
22
寛解期 第Ⅲ相試験(アサコール錠:2009.10.16承認、CTD2.7.6.3)
23
Suzuki Y,et al.:Inflamm Bowel Dis. 2017;23(5):822-832
24
メサラジンの活性酸素・フリーラジカルに対する作用(アサコール錠:2009.10.16承認、CTD2.6.2.2)
25
メサラジンのラット多形核白血球からのロイコトリエンB4産生抑制作用(アサコール錠:2009.10.16承認、CTD2.6.2.2)
26
Hori Y,et al.:Jpn J Pharmacol. 2001;85:155-160
27
社内資料:薬効比較試験(メサラジン腸溶錠400mg「VTRS」)