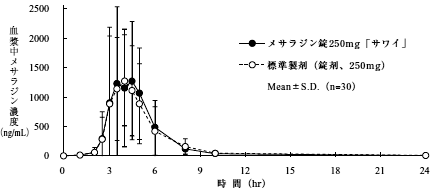
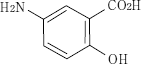
間質性肺疾患
(頻度不明)
間質性肺疾患(好酸球性肺炎、肺胞炎、肺臓炎、間質性肺炎等)が報告されているので、発熱、咳、呼吸困難、胸部X線異常等があらわれた場合には、投与を中止し適切な処置を行うこと。
心筋炎、心膜炎、胸膜炎
(頻度不明)
心筋炎、心膜炎、胸膜炎があらわれることがあるので、胸水、胸部痛、心電図異常等があらわれた場合には、投与を中止するなど適切な処置を行うこと。
**間質性腎炎、ネフローゼ症候群、腎機能低下、急性腎障害
(頻度不明)
間質性腎炎、ネフローゼ症候群、腎機能低下、急性腎障害があらわれることがあるので、投与期間中は腎機能検査値に注意するなど、患者の状態を十分に観察し、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
再生不良性貧血、汎血球減少、無顆粒球症、血小板減少症
(頻度不明)
再生不良性貧血、汎血球減少、無顆粒球症、血小板減少症があらわれることがあるので、投与期間中は血液検査を行うなど患者の状態を十分に観察し、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
肝炎、肝機能障害、黄疸
(頻度不明)
肝炎、AST(GOT)、ALT(GPT)、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがあるので、投与期間中は肝機能検査値に注意するなど、患者の状態を十分に観察し、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
膵炎
(頻度不明)
膵炎があらわれることがあるので、投与期間中は血清アミラーゼの検査を行うなど患者の状態を十分に観察し、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
**中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)
(頻度不明)
中毒性表皮壊死融解症、皮膚粘膜眼症候群があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
**薬剤性過敏症症候群
(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。