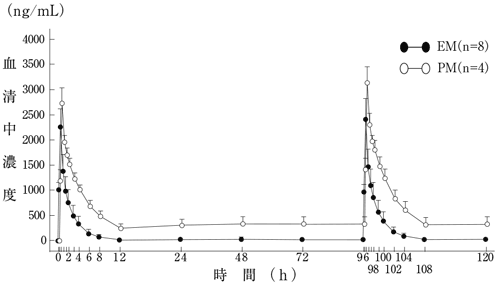
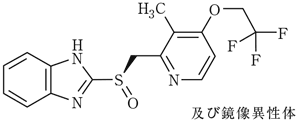
1
三輪 清 他:薬理と治療. 1990;18:3413-3435
2
Schardein J.L. et al.:薬理と治療. 1990;18(Suppl.10):2773-2783
3
Atkinson J.E. et al.:薬理と治療. 1990;18(Suppl.10):2713-2745
4
社内資料:注射用ランソプラゾールの臨床薬理試験成績(2006年10月20日承認:CTD2.7.2.2)
5
社内資料:注射用ランソプラゾールの蛋白結合に関する検討(2006年10月20日承認:CTD2.6.4.4)
6
社内資料:注射用ランソプラゾールの代謝に関する検討(2006年10月20日承認:CTD2.6.4.5)
7
社内資料:注射用ランソプラゾールの薬物動態試験成績(2006年10月20日承認:CTD2.7.6.3)
8
社内資料:注射用ランソプラゾールの臨床試験成績①(2006年10月20日承認:CTD2.7.6.21)
9
社内資料:注射用ランソプラゾールの臨床試験成績②(2006年10月20日承認:CTD2.7.6.23)
10
社内資料:注射用ランソプラゾールの臨床試験成績③(2006年10月20日承認:CTD2.7.6.25)
11
社内資料:注射用ランソプラゾールの薬理試験に関するまとめ①(2006年10月20日承認:CTD2.6.2.1)
12
社内資料:注射用ランソプラゾールの薬理試験に関するまとめ②(2006年10月20日承認:CTD2.6.2.2)
13
社内資料:注射用ランソプラゾールの薬理試験に関するまとめ③(2006年10月20日承認:CTD2.4.2.1)
14
社内資料:注射用ランソプラゾールの胃出血抑制作用に関する検討(2006年10月20日承認:CTD2.6.2.2)
15
社内資料:注射用ランソプラゾールの胃粘膜損傷形成抑制作用に関する検討(2006年10月20日承認:CTD2.6.2.2)
16
社内資料:注射用ランソプラゾールの胃酸分泌抑制作用に関する検討①(2006年10月20日承認:CTD2.7.6.8)
17
社内資料:注射用ランソプラゾールの胃酸分泌抑制作用に関する検討②(2006年10月20日承認:CTD2.7.6.9)
18
社内資料:注射用ランソプラゾールの胃酸分泌抑制作用に関する検討③(2006年10月20日承認:CTD2.7.6.7)
19
社内資料:注射用ランソプラゾールの胃酸分泌抑制作用に関する検討④(2006年10月20日承認:CTD2.7.6.10)