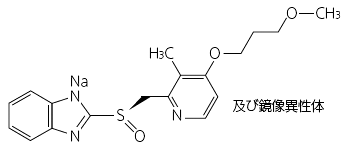
プロトンポンプ阻害剤
1錠 14.7円
| 製剤の性状 | 淡黄色のフィルムコーティング錠(腸溶錠) |
|---|---|
| 外形:表 |  |
| 外形:裏 |  |
| 外形:側面 |  |
| サイズ:直径(mm) | 5.9 |
| サイズ:厚さ(mm) | 2.6 |
| サイズ:重量(mg) | 69.5 |
| 識別コード | ラベプラゾール 5 ケミファ |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| アタザナビル硫酸塩(レイアタッツ) | アタザナビルの作用が減弱するおそれがある。 | 本剤の胃酸分泌抑制作用により、胃内pHが上昇し、アタザナビルの溶解性が低下し、アタザナビルの血中濃度が低下するおそれがある。 |
| リルピビリン塩酸塩(エジュラント) | リルピビリン塩酸塩の作用を減弱するおそれがある。 | 本剤の胃酸分泌抑制作用により、胃内pHが上昇し、リルピビリン塩酸塩の吸収が低下し、リルピビリンの血中濃度が低下することがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| ジゴキシン メチルジゴキシン | 相手薬剤の血中濃度が上昇することがある。 | 本剤の胃酸分泌抑制作用により、胃内pHが上昇し、相手薬剤の吸収を促進する。 |
| イトラコナゾール ゲフィチニブ | 相手薬剤の血中濃度が低下するおそれがある。 | 本剤の胃酸分泌抑制作用により、胃内pHが上昇し、相手薬剤の吸収を抑制するおそれがある。 |
| 水酸化アルミニウムゲル・水酸化マグネシウム含有の制酸剤 | ラベプラゾールナトリウム製剤単独投与に比べ制酸剤同時服用、制酸剤投与1時間後服用で平均血漿中濃度曲線下面積がそれぞれ8%、6%低下したとの報告がある。 | ラベプラゾールナトリウム製剤単独投与に比べ制酸剤同時服用、制酸剤投与1時間後服用で平均血漿中濃度曲線下面積がそれぞれ8%、6%低下したとの報告がある。 |
| メトトレキサート | メトトレキサートの血中濃度が上昇することがある。高用量のメトトレキサートを投与する場合は、一時的に本剤の投与を中止することを考慮すること。 | 機序は不明である。 |