作成又は改訂年月
**
2019年7月改訂
(第13版)
*
2017年12月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
**ラベプラゾールNa錠20mg「武田テバ」
販売名コード
承認・許可番号
**30100AMX00107
Rabeprazole Na Tab. 20mg “TAKEDA TEVA”
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存(開封後は湿気を避けて保存すること)
使用期限
3年(外箱に表示)
規制区分
処方箋医薬品
注意−医師等の処方箋により使用すること
組成
有効成分
日局 ラベプラゾールナトリウム
含量
1錠中 20mg
添加物
D-マンニトール、酸化マグネシウム、結晶セルロース、ヒドロキシプロピルセルロース、カルメロースカルシウム、低置換度ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、エチルセルロース、ヒプロメロースフタル酸エステル、グリセリン脂肪酸エステル、酸化チタン、黄色三二酸化鉄、カルナウバロウ
性状
淡黄色の腸溶フィルムコーティング錠
外形(表面)
外形(裏面)
外形(側面)
直径
7.2mm
厚み
3.7mm
質量
約142mg
識別コード
TYK501
一般的名称
禁忌
本剤の成分に対し過敏症の既往歴のある患者
アタザナビル硫酸塩、リルピビリン塩酸塩を投与中の患者(「相互作用」の項参照)
効能又は効果
効能又は効果に関連する使用上の注意
本剤の投与が胃癌による症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、Zollinger-Ellison症候群
用法及び用量
・胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison症候群:
通常、成人にはラベプラゾールナトリウムとして1回10mgを1日1回経口投与するが、病状により1回20mgを1日1回経口投与することができる。なお、通常、胃潰瘍、吻合部潰瘍では8週間まで、十二指腸潰瘍では6週間までの投与とする。
・逆流性食道炎:
逆流性食道炎の治療においては、通常、成人にはラベプラゾールナトリウムとして1回10mgを1日1回経口投与するが、病状により1回20mgを1日1回経口投与することができる。なお、通常、8週間までの投与とする。また、プロトンポンプインヒビターによる治療で効果不十分な場合、1回10mg又は1回20mgを1日2回、さらに8週間経口投与することができる。ただし、1回20mg1日2回投与は重度の粘膜傷害を有する場合に限る。
用法及び用量に関連する使用上の注意
胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison症候群の治療において、病状が著しい場合及び再発性・難治性の場合に1回20mgを1日1回投与することができる。
逆流性食道炎の治療において、病状が著しい場合及び再発性・難治性の場合に1回20mgを1日1回投与することができる(再発・再燃を繰り返す逆流性食道炎の維持療法、プロトンポンプインヒビターによる治療で効果不十分な場合は除く)。また、プロトンポンプインヒビターによる治療で効果不十分な患者に対し1回10mg又は1回20mgを1日2回、さらに8週間投与する場合は、内視鏡検査で逆流性食道炎が治癒していないことを確認すること。なお、本剤1回20mgの1日2回投与は、内視鏡検査で重度の粘膜傷害を確認した場合に限る。
使用上の注意
慎重投与
薬物過敏症の既往歴のある患者
肝障害のある患者〔肝硬変患者で肝性脳症の報告がある。〕
高齢者(「高齢者への投与」の項参照)
重要な基本的注意
治療にあたっては経過を十分に観察し、病状に応じ治療上必要最小限の使用にとどめること。
本剤の投与中には、血液像や肝機能に注意し、定期的に血液学的検査・血液生化学的検査を行うことが望ましい。また、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
胃潰瘍、十二指腸潰瘍、吻合部潰瘍については、長期の使用経験は十分でないので、維持療法には用いないことが望ましい。
相互作用
本剤の代謝には肝代謝酵素チトクロームP450 2C19(CYP2C19)及び3A4(CYP3A4)の関与が認められている。
また、本剤の胃酸分泌抑制作用により、併用薬剤の吸収を促進又は抑制することがある。
併用禁忌
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
アタザナビル硫酸塩
(レイアタッツ) | アタザナビルの作用が減弱するおそれがある。 | 本剤の胃酸分泌抑制作用により、胃内pHが上昇し、アタザナビルの溶解性が低下し、アタザナビルの血中濃度が低下するおそれがある。 |
|---|
リルピビリン塩酸塩
(エジュラント) | リルピビリン塩酸塩の作用を減弱するおそれがある。 | 本剤の胃酸分泌抑制作用により、胃内pHが上昇し、リルピビリン塩酸塩の吸収が低下し、リルピビリンの血中濃度が低下することがある。 |
|---|
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
ジゴキシン
メチルジゴキシン | 相手薬剤の血中濃度が上昇することがある。 | 本剤の胃酸分泌抑制作用により、胃内pHが上昇し、相手薬剤の吸収を促進する。 |
|---|
イトラコナゾール
ゲフィチニブ | 相手薬剤の血中濃度が低下するおそれがある。 | 本剤の胃酸分泌抑制作用により、胃内pHが上昇し、相手薬剤の吸収を抑制するおそれがある。 |
|---|
| 水酸化アルミニウムゲル・水酸化マグネシウム含有の制酸剤 | 本剤単独投与に比べ制酸剤同時服用、制酸剤投与1時間後服用で平均血漿中濃度曲線下面積がそれぞれ8%、6%低下したとの報告がある。 | 本剤単独投与に比べ制酸剤同時服用、制酸剤投与1時間後服用で平均血漿中濃度曲線下面積がそれぞれ8%、6%低下したとの報告がある。 |
|---|
| メトトレキサート | メトトレキサートの血中濃度が上昇することがある。高用量のメトトレキサートを投与する場合は、一時的に本剤の投与を中止することを考慮すること。 | 機序は不明である。 |
|---|
副作用
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
ショック、アナフィラキシー:
(頻度不明)
ショック、アナフィラキシーがあらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し適切な処置を行うこと。
汎血球減少、無顆粒球症、血小板減少、溶血性貧血:
(頻度不明)
汎血球減少、無顆粒球症、血小板減少、溶血性貧血があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し適切な処置を行うこと。
劇症肝炎、肝機能障害、黄疸:
(頻度不明)
劇症肝炎、肝機能障害、黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し適切な処置を行うこと。
間質性肺炎:
(頻度不明)
間質性肺炎があらわれることがあるので、発熱、咳嗽、呼吸困難、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線等の検査を実施し、本剤の投与を中止するとともに、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑:
(頻度不明)
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑等の皮膚障害があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し適切な処置を行うこと。
急性腎障害、間質性腎炎:
(頻度不明)
急性腎障害、間質性腎炎があらわれることがあるので、腎機能検査(BUN、クレアチニン等)に注意し、異常が認められた場合には投与を中止し適切な処置を行うこと。
低ナトリウム血症:
(頻度不明)
低ナトリウム血症があらわれることがあるので、異常が認められた場合には投与を中止し適切な処置を行うこと。
横紋筋融解症:
(頻度不明)
筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがあるので、このような場合には投与を中止し適切な処置を行うこと。
重大な副作用(類薬)
類薬(オメプラゾール)で以下の副作用が報告されている。
視力障害:
視力障害があらわれることがあるので、異常が認められた場合には投与を中止し適切な処置を行うこと。
錯乱状態:
せん妄、異常行動、失見当識、幻覚、不安、焦燥、攻撃性等があらわれることがあるので、異常が認められた場合には投与を中止し適切な処置を行うこと。
その他の副作用
以下のような副作用があらわれた場合には、症状に応じて適切な処置を行うこと。
過敏症
頻度不明
発疹、そう痒感、蕁麻疹
血液
頻度不明
白血球減少、白血球増加、好酸球増多、貧血、赤血球減少、好中球増多、リンパ球減少
肝臓
頻度不明
AST(GOT)、ALT(GPT)、Al-P、γ-GTP、LDH、総ビリルビンの上昇
循環器
頻度不明
血圧上昇、動悸
消化器
頻度不明
便秘、下痢、腹部膨満感、嘔気、口内炎、腹痛、苦味、カンジダ症、胃もたれ、口渇、食欲不振、鼓腸、舌炎、嘔吐、顕微鏡的大腸炎(collagenous colitis、lymphocytic colitis)
精神神経系
頻度不明
頭痛、めまい、ふらつき、眠気、四肢脱力、知覚鈍麻、握力低下、口のもつれ、失見当識、せん妄、昏睡
その他
頻度不明
総コレステロール・中性脂肪・BUNの上昇、蛋白尿、血中TSH増加、かすみ目、浮腫、けん怠感、発熱、脱毛症、しびれ感、CK(CPK)の上昇、目のちらつき、関節痛、筋肉痛、高アンモニア血症、低マグネシウム血症、女性化乳房
高齢者への投与
本剤は主として肝臓で代謝されるが、高齢者では肝機能が低下していることが多く、副作用があらわれることがあるので、消化器症状等の副作用(「副作用」の項参照)があらわれた場合は休薬するなど慎重に投与すること。
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔動物実験(ラット経口400mg/kg、ウサギ静注30mg/kg)で胎児毒性(ラットで化骨遅延、ウサギで体重の低下、化骨遅延)が報告されている。〕
授乳中の婦人への投与は避けることが望ましいが、やむを得ず投与する場合は、授乳を避けさせること。〔動物実験(ラット)で乳汁中へ移行することが報告されている。〕
小児等への投与
小児等に対する安全性は確立していない(使用経験がない)。
適用上の注意
服用時:
本剤は腸溶錠であり、服用にあたっては、噛んだり、砕いたりせずに、のみくだすよう注意すること。
薬剤交付時:
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
ラットに5mg/kg以上を2年間経口投与した毒性試験において、雌で胃にカルチノイドの発生がみられたとの報告がある。
動物実験(ラット経口投与25mg/kg以上)で甲状腺重量及び血中サイロキシンの増加が報告されているので、使用にあたっては甲状腺機能に注意する。
本剤の長期投与中に良性の胃ポリープを認めたとの報告がある。
海外における複数の観察研究で、プロトンポンプインヒビターによる治療において骨粗鬆症に伴う股関節骨折、手関節骨折、脊椎骨折のリスク増加が報告されている。特に、高用量及び長期間(1年以上)の治療を受けた患者で、骨折のリスクが増加した。
海外における主に入院患者を対象とした複数の観察研究で、プロトンポンプインヒビターを投与した患者においてクロストリジウム・ディフィシルによる胃腸感染のリスク増加が報告されている。
薬物動態
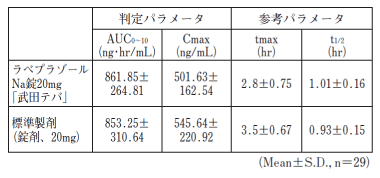
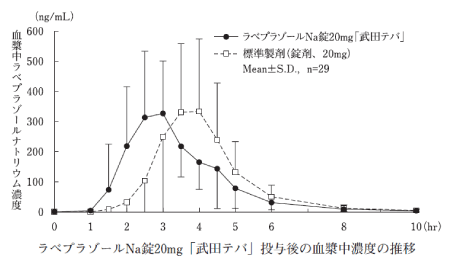
生物学的同等性試験1)
ラベプラゾールNa錠20mg「武田テバ」と標準製剤をクロスオーバー法により、それぞれ1錠(ラベプラゾールナトリウムとして20mg)を健康成人男子に空腹時単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
薬効薬理
ラベプラゾールは、プロトンポンプ阻害剤である。酸分泌細胞の酸性領域で活性体(スルフェンアミド体)になり、プロトンポンプ(H+、K+−ATPase)のSH基を修飾して酵素活性を阻害し、酸分泌を抑制する2)。
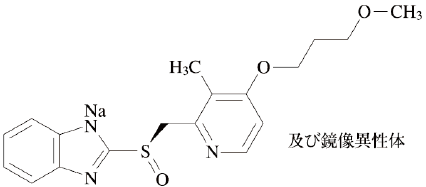
有効成分に関する理化学的知見
一般名
ラベプラゾールナトリウム、Rabeprazole Sodium(JAN)
化学名
Monosodium(RS)-2-({[4-(3-methoxypropoxy)-3-methylpyridin-2-yl]methyl}sulfinyl)-1H-benzimidazolide
分子式
C18H20N3NaO3S
分子量
381.42
構造式
性状
白色〜微黄白色の粉末である。
水に極めて溶けやすく、エタノール(99.5)に溶けやすい。
0.01mol/L水酸化ナトリウム試液に溶ける。
吸湿性である。
水溶液(1→20)は旋光性を示さない。
結晶多形が認められる。
取扱い上の注意
安定性試験3)
最終包装製品を用いた加速試験(40℃、相対湿度75%、6ヵ月)の結果、本剤は通常の市場流通下において3年間安定であることが推測された。
包装
ラベプラゾールNa錠20mg「武田テバ」:100錠(PTP10錠×10)
主要文献及び文献請求先
主要文献
1
武田テバ薬品(株):社内資料(生物学的同等性試験)
2
第十七改正日本薬局方解説書,廣川書店 2016;C-5712
3
武田テバ薬品(株):社内資料(安定性試験)
文献請求先・製品情報お問い合わせ先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
武田テバ薬品株式会社 武田テバDIセンター
〒453-0801 名古屋市中村区太閤一丁目24番11号
TEL 0120-923-093
受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製造販売業者等の氏名又は名称及び住所
販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号
発売元
武田テバファーマ株式会社
名古屋市中村区太閤一丁目24番11号
製造販売元
武田テバ薬品株式会社
大阪市中央区道修町四丁目1番1号