1
春木左千夫ほか:薬理と治療. 1995;23(11):3049-3059
2
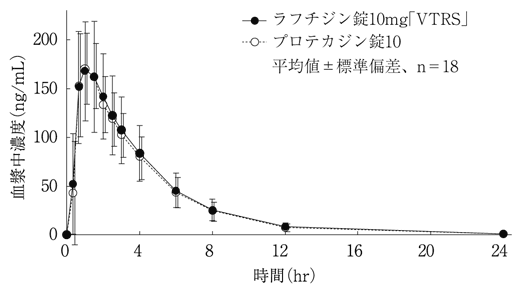
社内資料:生物学的同等性試験(ラフチジン錠10mg「VTRS」)
3
蛋白結合率(プロテカジン錠:2000.1.18承認、申請資料概要ヘ.2)
4
代謝(プロテカジン錠:2000.1.18承認、申請資料概要へ)
5
古橋三義ほか:透析会誌. 2002;35(1):35-42
6
社内資料:溶出試験(ラフチジン錠5mg「VTRS」)
7
森賀本幸ほか:臨床医薬. 1995(1998年改訂);11(Suppl.4):3-21
8
森賀本幸ほか:臨床医薬. 1995(1998年改訂);11(Suppl.4):23-34
9
中澤三郎ほか:臨床医薬. 1995(1998年改訂);11(Suppl.4):35-48
10
三輪剛ほか:臨床医薬. 1995(1998年改訂);11(Suppl.4):49-62
11
早川滉:臨床医薬. 1995(1998年改訂);11(Suppl.4):75-85
12
森治樹:臨床医薬. 1995(1998年改訂);11(Suppl.4):87-96
13
三輪剛ほか:臨床医薬. 1995(1998年改訂);11(Suppl.4):63-74
14
松尾裕ほか:臨床医薬. 1998;14(11):2085-2102
15
松尾裕ほか:臨床医薬. 1998;14(11):2103-2119
16
三好秋馬ほか:臨床医薬. 1995(1998年改訂);11(Suppl.4):97-111
17
三好秋馬ほか:臨床医薬. 1995(1998年改訂);11(Suppl.4):113-129
18
三好秋馬ほか:臨床医薬. 1998;14(11):2121-2138
19
野口純一ほか:臨床医薬. 1995(1998年改訂);11(Suppl.4):159-171
20
野口純一ほか:臨床医薬. 1995;11(10):2143-2158
21
Ohara S,et al.:J Gastroenterol. 2010;45:1219-1227
22
森治樹ほか:臨床医薬. 1995;11(7):1381-1393
23
森治樹ほか:臨床医薬. 1995;11(7):1395-1407
24
森治樹ほか:臨床医薬. 1995;11(7):1409-1422
25
谷礼夫ほか:臨床医薬. 1995;11(8):1667-1678
26
森治樹ほか:消化器の臨床. 2002;5(2):200-206
27
Ichikawa T,et al.:J Gastroenterol Hepatol. 2007;22(11):1800-1805
28
Shibata M,et al.:Eur J Pharmacol. 1993;235:245-253
29
稲葉二朗ほか:日薬理誌. 1995;105(4):231-241
30
Onodera S,et al.:Jpn J Pharmacol. 1995;68(2):161-173
31
山浦哲明ほか:日薬理誌. 1992;99(6):401-410
32
小野寺禎良ほか:日薬理誌. 1998;111(3):167-175
33
Ajioka H,et al.:Pharmacology. 2000;61(2):83-90
34
小野寺禎良ほか:日薬理誌. 1997;109(1):31-40
35
急性逆流性食道炎に対する作用(プロテカジン錠:2010.3.12承認、審査報告書)
36
柴田昌裕ほか:実験潰瘍. 1997;24(1):33-37
37
Ichikawa T,et al.:Eur J Pharmacol. 1994;251:107-111
38
Ichikawa T,et al.:Life Sci. 1994;54(10):159-164
39
鹿児島正豊ほか:日薬理誌. 1994;104(5):379-389
40
小野寺禎良ほか:実験潰瘍. 1998;25(2):217-220