1
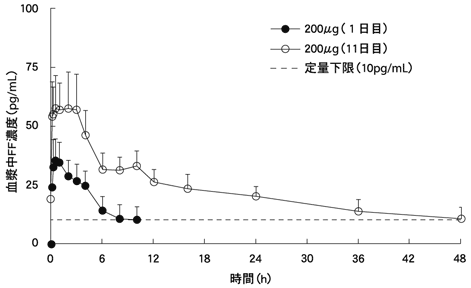
Nakahara N,et al.:Int J Clin Pharmacol Ther.2013;51(8):660-671
2
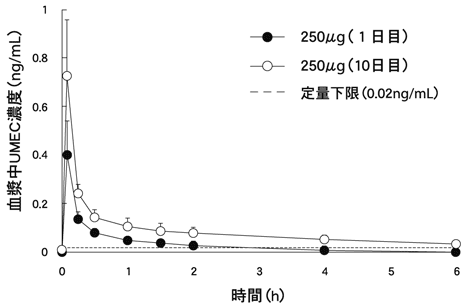
Mehta R,et al.:Int J Chron Obstruct Pulmon Dis.2015;10:15-23
3
Mehta R,et al.:Clin Ther.2014;36(7):1016-1027
4
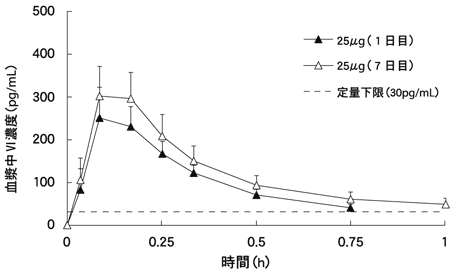
Kempsford R,et al.:Br J Clin Pharmacol.2013;75(6):1478-1487
5
Mehta R,et al.:Int J Chron Obstruct Pulmon Dis.2013;8:159-167
6
Lipson DA,et al.:N Engl J Med.2018;378:1671-1680
7
Dmitrienko A,et al.:Biometrical J.2008;50(5):667-677
8
Kelleher D,et al.:Pulm Pharmacol Ther.2014;29(1):49-57
9
McCormack PL,et al.:Drugs.2007;67:1905-1915