1
健康成人における薬物動態(国内第Ⅰ相試験J3027-01)(2012年3月30日承認,申請資料概要2.7.2.2.1)
2
健康成人・嚢胞性線維症患者における薬物動態(海外第Ⅰ相試験Z0197g)(2012年3月30日承認,申請資料概要2.7.2.2.4)
3
嚢胞性線維症患者における薬物動態(海外第Ⅰ相試験Z0196g)(2012年3月30日承認,申請資料概要2.7.2.2.3)
4
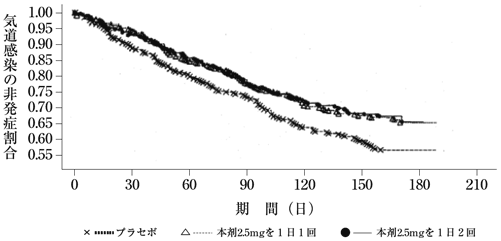
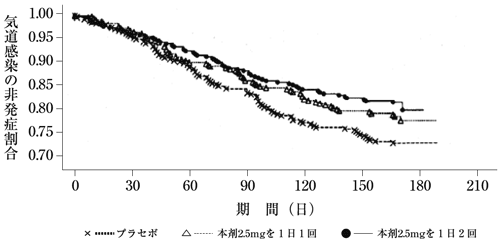
海外第Ⅲ相試験Z0342g/Z0343g(2012年3月30日承認,申請資料概要2.7.3.3.2.2)
5
Shah PI, et al. Eur Respir J. 1995; 8: 954-8.
6
McCoy K, et al. Chest. 1996; 110: 889-95.
7
Shak S, et al. Proc Natl Acad Sci USA. 1990; 87: 9188-92.