1
Ali-Melkkila et al. Anaesthesia. 1990;45:634-637
2
社内資料:ラット胚・胎児発生に関する試験(試験番号14-762)(2019年6月18日承認、CTD2.6.6.6)
3
社内資料:ウサギ胚・胎児発生に関する試験(試験番号14-763)(2019年6月18日承認、CTD2.6.6.6)
4
社内資料:出生前及び出生後の発生並びに母体の機能に関する試験(試験番号14-765)(2019年6月18日承認、CTD2.6.6.6)
5
社内資料:妊娠前及び妊娠中・授乳期投与試験(2009年10月16日承認、CTD2.6.6.6)
6
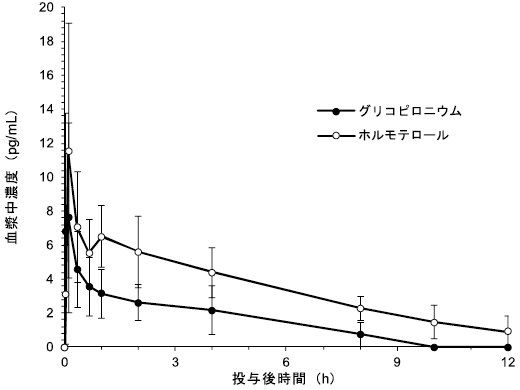
社内資料:日本人におけるグリコピロニウム/ホルモテロールフマル酸塩及びグリコピロニウムの単回投与薬物動態(PT003010)(2019年6月18日承認、CTD2.7.1.2)
7
社内資料:中等症から最重症の慢性閉塞性肺疾患患者を対象とした第III相国際共同臨床試験(PINNACLE1試験;PT003006)(2019年6月18日承認、CTD2.7.1.2)
8
社内資料:グリコピロニウムのin vitro血漿蛋白結合(BS001265-58)(2019年6月18日承認、CTD2.7.2.1)
9
社内資料:ホルモテロールのin vitro血漿蛋白結合(843-RD-0354)(2009年10月16日承認、CTD2.7.2.2)
10
社内資料:グリコピロニウム/ホルモテロールフマル酸塩の肺への沈着(PT003020)(2019年6月18日承認、CTD2.7.2.2)
11
社内資料:グリコピロニウムのin vitro代謝(BE001294-70)(2019年6月18日承認、CTD2.7.2.1)
12
社内資料:グリコピロニウムの代謝に関与するシトクロムP450の検討(BS001884-09)(2019年6月18日承認、CTD2.7.2.1)
13
Rösenborg J, et al. Drug Metab Dispos. 1999;27:1104-16.
14
社内資料:ホルモテロールのシトクロムP450阻害作用の検討(843-RD-0395)(2009年10月16日承認、CTD2.7.2.2)
15
Kaltiala E, et al. J Pharm Pharmacol. 1974;26:352-4.
16
社内資料:母集団薬物動態解析(2019年6月18日承認、CTD2.7.2.3)
17
社内資料:中等症から最重症の慢性閉塞性肺疾患患者を対象とした第III相国際共同臨床試験(PINNACLE4試験;PT003014)(2019年6月18日承認、CTD2.7.6.2)
18
社内資料:グリコピロニウム/ホルモテロールフマル酸塩及びグリコピロニウムの心血管系への影響を検討する安全性試験(PT003009)(2019年6月18日承認、CTD2.7.2.2)
19
Sykes DA, et al. J Pharmacol Exp Ther. 2012;343(2):520-8.
20
Ullman A, et al. Allergy 1992;47:384-7.
21
社内資料:ヒトM1受容体に対するグリコピロニウムの阻害活性(2019年6月18日承認、CTD2.6.2.2)
22
社内資料:ヒトM2受容体に対するグリコピロニウムの阻害活性(2019年6月18日承認、CTD2.6.2.2)
23
社内資料:ヒトM3受容体に対するグリコピロニウムの阻害活性(2019年6月18日承認、CTD2.6.2.2)
24
Trifilieff A, et al. Toxicol Appl Pharmacol. 2015;287(1):9-16.
25
Ida H. Arzneimittelforschung. 1976;26(7):1337-40.