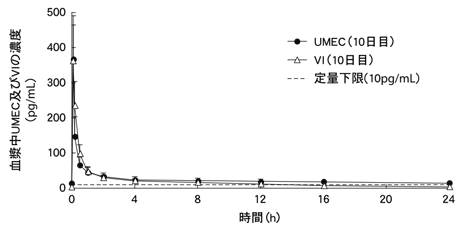
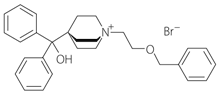
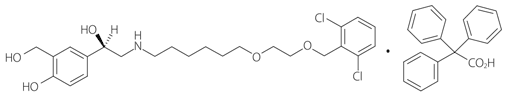
1
Mehta R,et al.:Int J Chron Obstruct Pulmon Dis.2015;10:15-23
2
Mehta R,et al.:Clin Ther.2014; 36(7):1016-1027
3
Kempsford R,et al.:Br J Clin Pharmacol.2013; 75(6):1478-1487
4
Mehta R,et al.:Int J Chron Obstruct Pulmon Dis.2013; 8:159-167
5
Donohue JF,et al.:Respir Med. 2013;107(10):1538-1546
6
南方良章ほか:呼吸.2014; 33:1037-1047
7
Kelleher D,et al.:Pulm Pharmacol Ther. 2014; 29(1):49-57