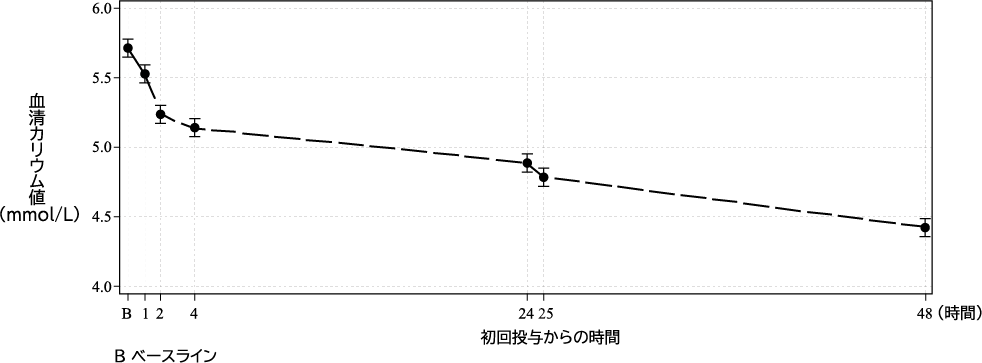
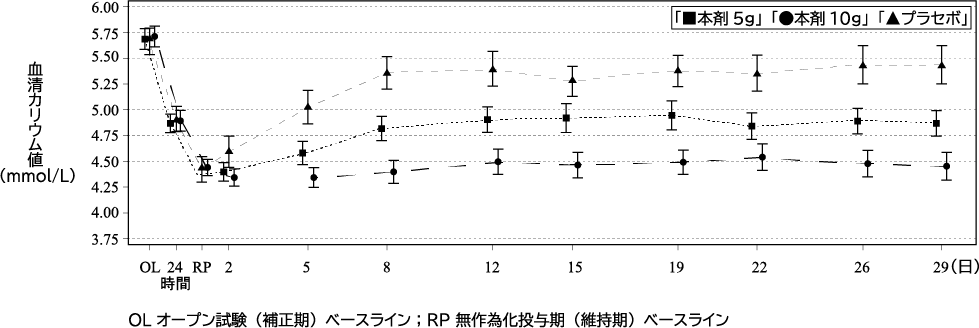
1
社内資料:海外第III相試験(ZS-004試験)(2020年3月25日承認、CTD2.7.1.2.2)
2
社内資料:in vitro相互作用試験(2020年3月25日承認、CTD2.6.4.7.8)
3
社内資料:海外第I相試験(ZS-009試験)(2020年3月25日承認、CTD2.7.2.2.2.2)
4
社内資料:タクロリムス及びシクロスポリンの薬物動態に対するジルコニウムシクロケイ酸ナトリウム水和物の影響を検討した第I相試験(D9480C00012試験)
5
Kashihara N, et al. Clin Exp Nephrol. 2020 Dec;24(12):1144-53.
6
Zannad F, et al. ESC Heart Fail. 2020 Feb;7(1):55-65
7
Kashihara N, et al. Clin Exp Nephrol. 2021 Feb;25(2):140-9.
8
Fishbane S, et al. J Am Soc Nephrol. 2019 Sep;30(9):1723-33.
9
Stavros F, et al. PLoS One. 2014 Dec;9(12):e114686.
10
Koshiborod M, et al. JAMA. 2014 Dec;312(21):2223-33.
11
社内資料:海外第I相試験ZS-006試験(2020年3月25日承認、CTD2.7.2.2.2.1)