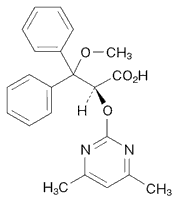
1
日本人健康成人男性を対象とした単回経口投与試験(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
2
日本人肺動脈高血圧症(PAH)患者を対象とした試験(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
3
母集団薬物動態解析(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.3)
4
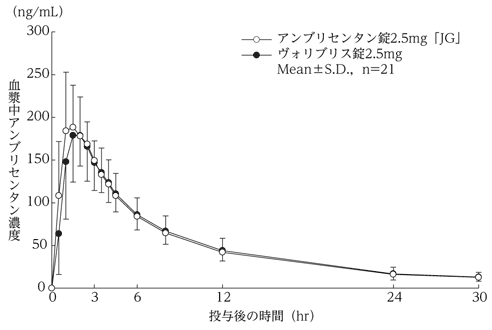
社内資料:生物学的同等性試験
5
食事の影響(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.1.2)
6
分布(ヴォリブリス錠:2010年7月23日承認、申請資料概要2.6.4.4)
7
代謝(ヴォリブリス錠:2010年7月23日承認、申請資料概要2.6.4.5)
8
2H,14C標識したアンブリセンタンにおける成績(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
9
腎障害患者(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.3)
10
肝障害患者(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.3)
11
薬物相互作用(代謝酵素に及ぼす影響)(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.4.5)
12
各種トランスポーターに対する影響(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.6.4.7)
13
肝取込み・排出トランスポーターに関する試験(ヴォリブリス錠:2021年3月23日承認、申請資料概要 2.6.4.7)
14
外国人健康成人男性を対象とした臨床薬理試験(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
15
シクロスポリンAとの相互作用の検討(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
16
ケトコナゾールとの相互作用の検討(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
17
リファンピシンとの相互作用の検討(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
18
経口避妊薬との相互作用の検討(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
19
ジゴキシンとの相互作用の検討(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
20
その他の薬物相互作用試験(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
21
シルデナフィルとの相互作用の検討(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
22
タダラフィルとの相互作用の検討(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
23
ワルファリンとの相互作用の検討(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.2.2)
24
Yoshida, S. et al.:Curr. Med. Res. Opin. 2011;27:1827-1834
25
有効性の成績(AMB107816試験)(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.5.4.3)
26
有害事象の解析(PAH患者を対象とした臨床試験(国内第Ⅱ/Ⅲ相試験))(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.4.2)
27
Yoshida, S. et al.:Curr. Med. Res. Opin. 2012;28:1069-1076
28
有害事象の解析(PAH患者を対象とした臨床試験(国内第Ⅲ相試験))(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.4.2)
29
Galié, N. et al.:J. Am. Coll. Cardiol. 2005;46:529-535
30
有害事象の解析(PAH患者を対象とした臨床試験(海外第Ⅱ相試験))(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.4.2)
31
McGoon, M.D. et al.:Chest. 2009;135:122-129
32
臨床検査(肝障害)(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.5.5.4)
33
AMB-320/321-C試験(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.6)
34
AMB-220-E試験(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.7.6)
35
Galié, N. et al.:Cardiovasc. Res. 2004;61:227-237
36
作用機序(ヴォリブリス錠:2010年7月23日承認、申請資料概要 2.6.2.2)
37
Schroll, S. et al.:Scand. J. Clin. Lab. Invest. 2008;68:270-276