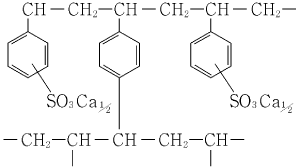
1
Fernandez PC, et al.:N Engl J Med. 1972;286:23-4
2
Ziessman HA.:South Med J. 1976;69:497-9
3
Schroeder ET.:Gastroenterology. 1969;56:868-74
4
Minford EJ, et al.:Postgrad Med J. 1992;68:302
5
和知正幸他:基礎と臨床. 1973;7:3528-30
6
Payne JM, et al.:Nature. 1960;188:586-7
7
鈴木好夫他:診療と保険. 1973;15:1794-808
8
和知正幸他:日本薬理学雑誌. 1973;69:863-8
9
片岡是充:診療と新薬. 1973;10:1013-9
10
平沢由平:診療と新薬. 1973;10:1021-9
11
社内資料:生物学的同等性試験-カリウム交換容量比較試験-
12
社内資料:生物学的同等性試験-両腎臓摘出ラットを用いた薬力学的試験-