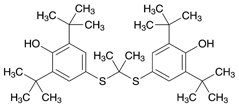
1
近藤和雄 他:動脈硬化.1983;10(6):1103-1106
2
泉 寛治 他:動脈硬化.1984;12(4):973-984
3
Yamamoto, A. et al.:Atherosclerosis.1983;48(2):157-166
4
渡辺 彰 他:動脈硬化.1983;11(3):597-602
5
Tomikawa,M. et al.:Atherosclerosis.1981;40(2):101-113
6
俵 克彦 他:動脈硬化.1983;10(6):1119-1124
7
Matsuzawa, Y. et al.:Am. J. Cardiol.1988;62(3):66B-72B
8
Parthasarathy, S. et al.:J. Clin. Invest.1986;77(2):641-644
9
Kita, T. et al.:Proc. Natl. Acad. Sci. USA.1987;84(16):5928-5931
10
大島研三 他:医学のあゆみ.1983;125(6):588-602
11
秦 葭哉 他:老年医学.1982;20(4):683-695
12
岡本良三 他:動脈硬化. 1984; 10(4): 863-867.
13
Kritchevsky, D. et al.:Proc. Soc. Exp. Biol. Med.1971;136(4):1216-1221
14
Wissler,R. W. et al.:Appl. Pathol.1983;1(2):89-96
15
Miettinen, T.A. et al.:Lancet.1981;2(8244):478