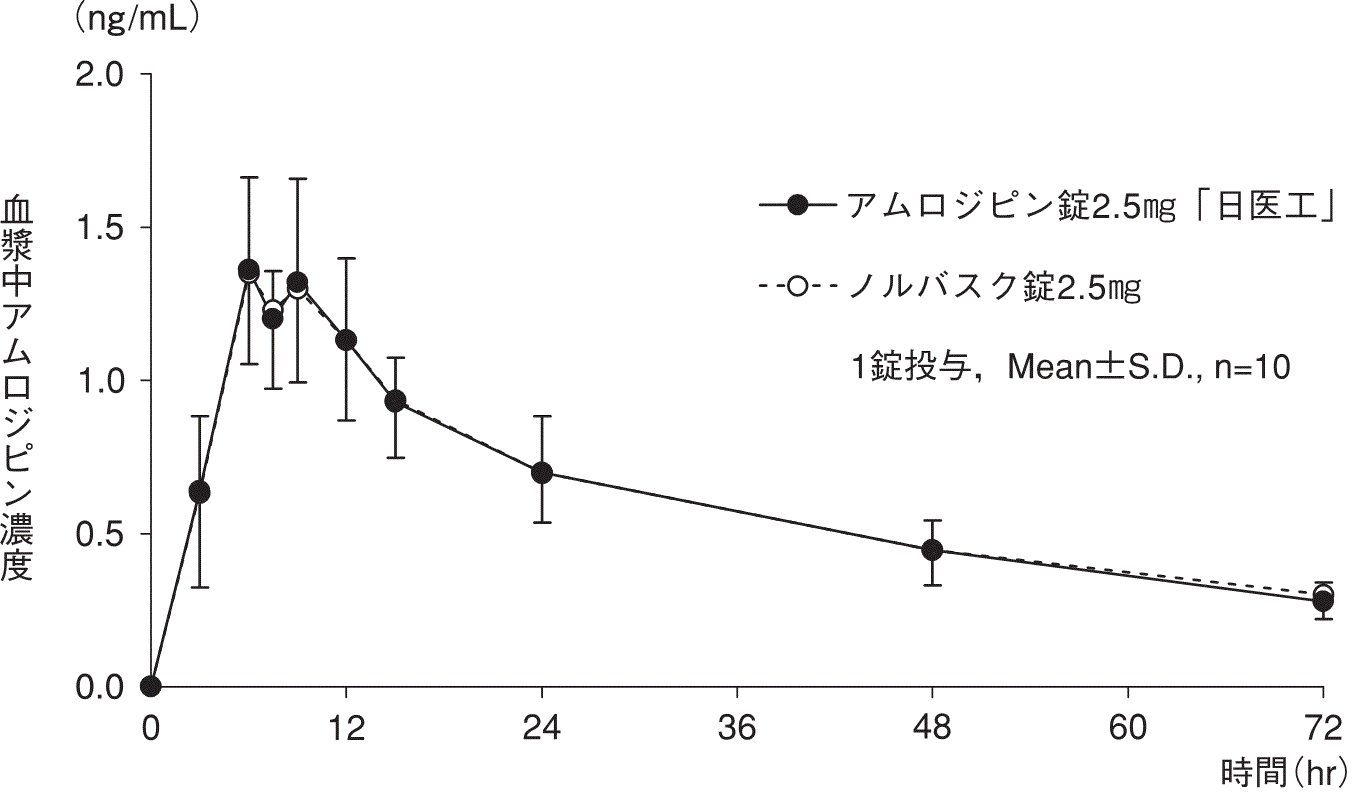
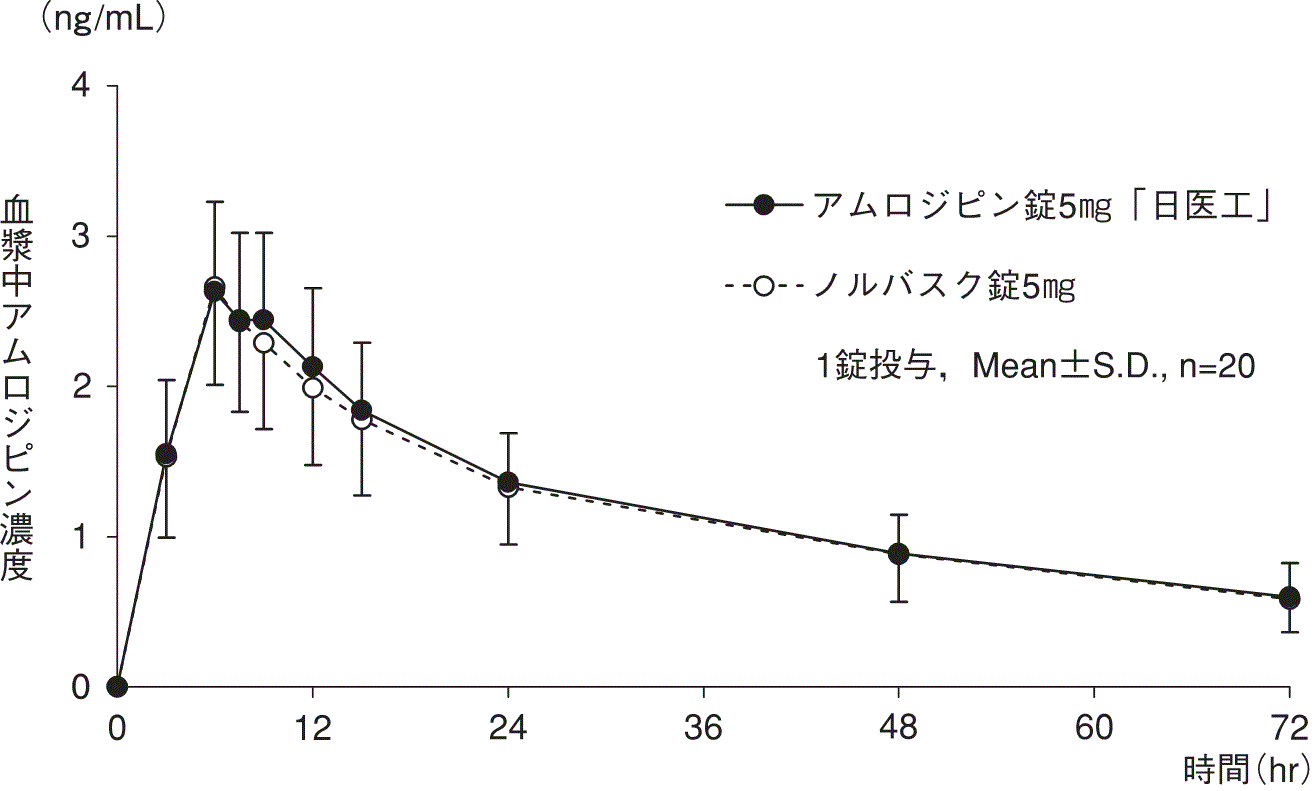
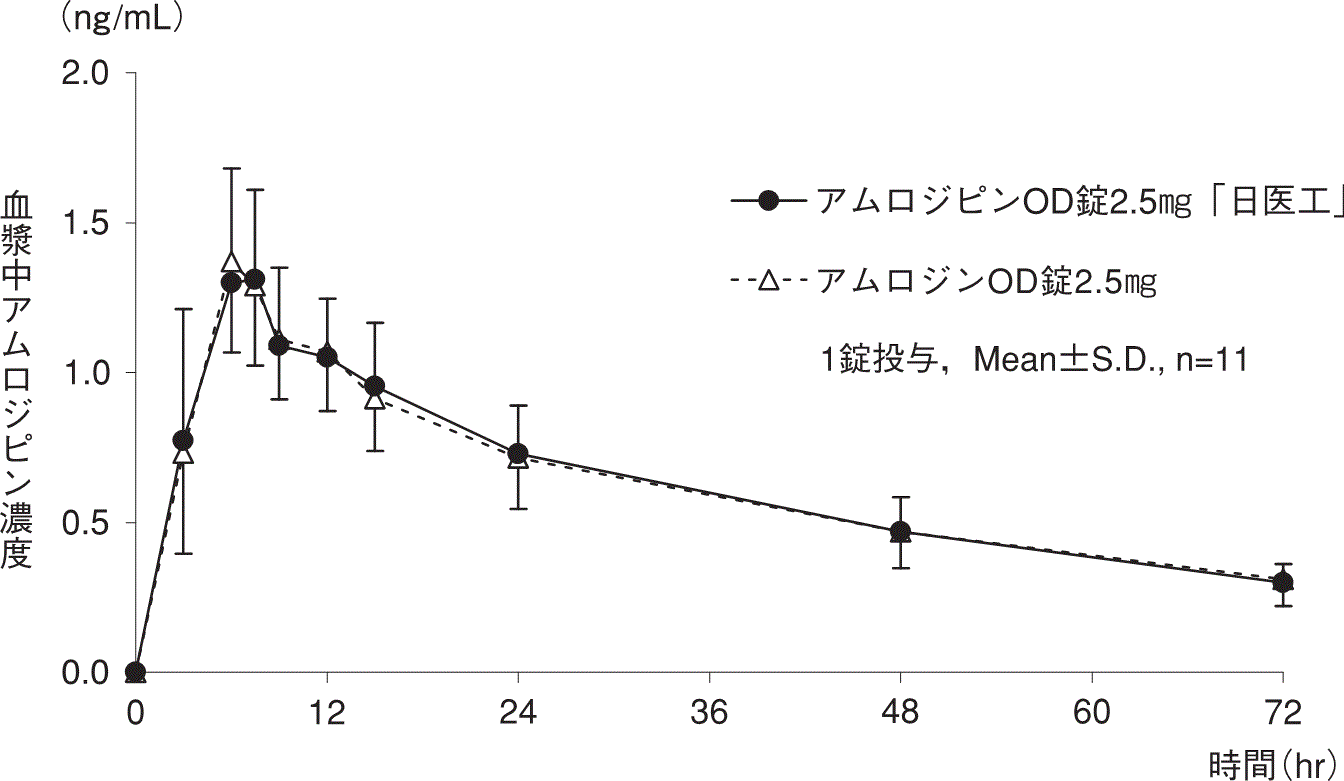
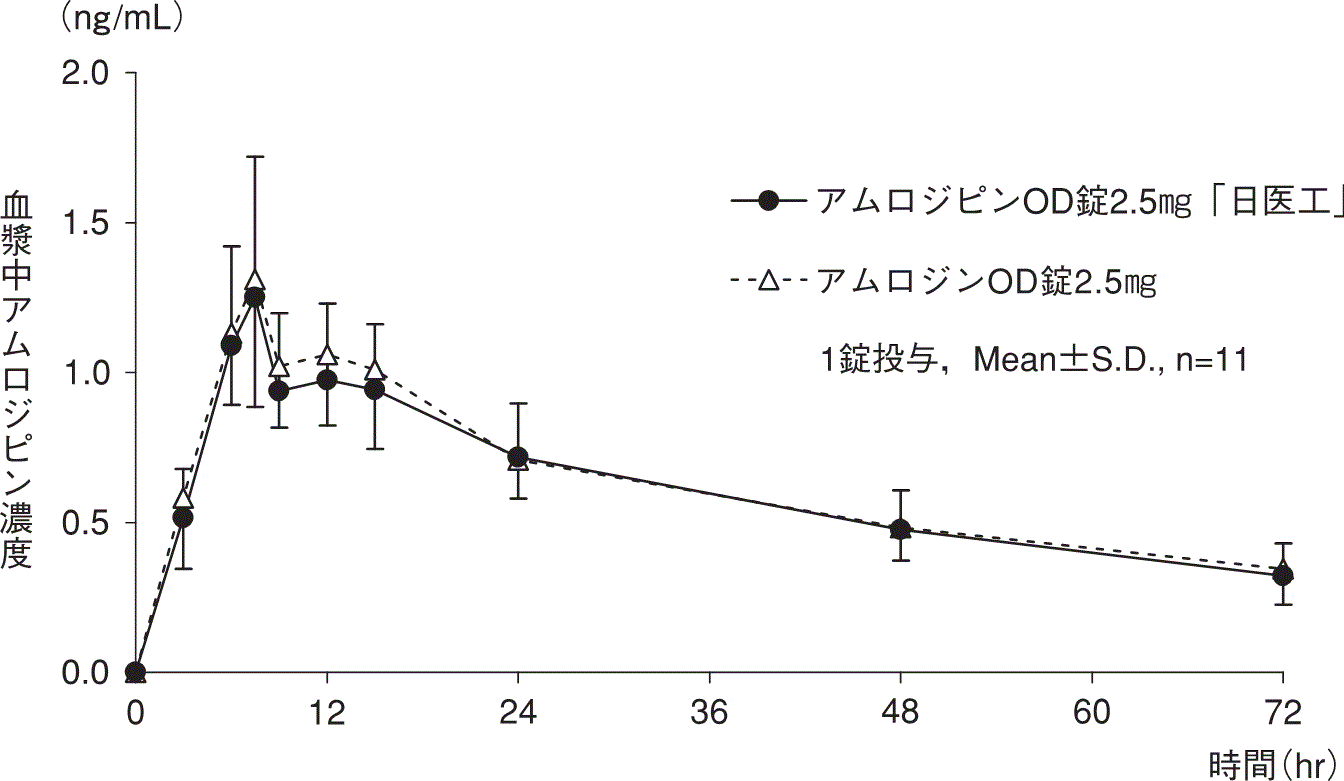
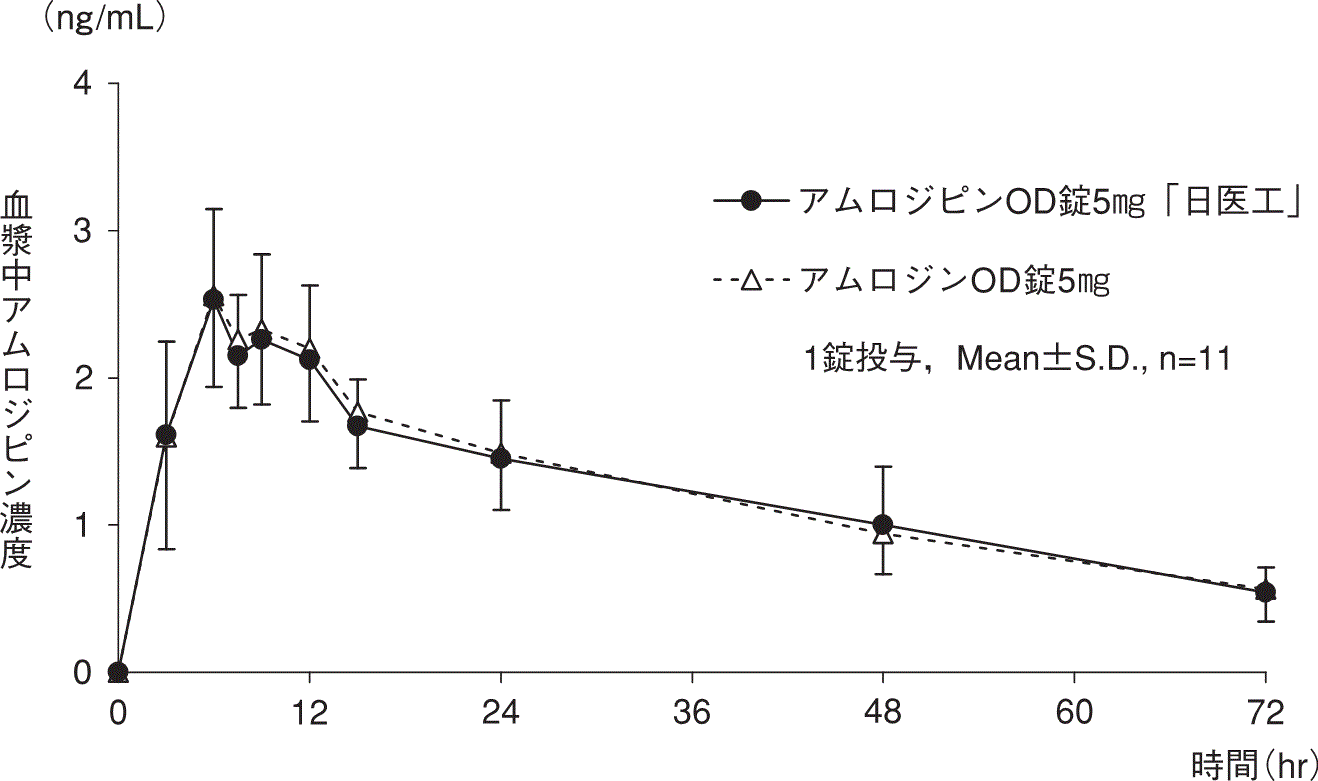
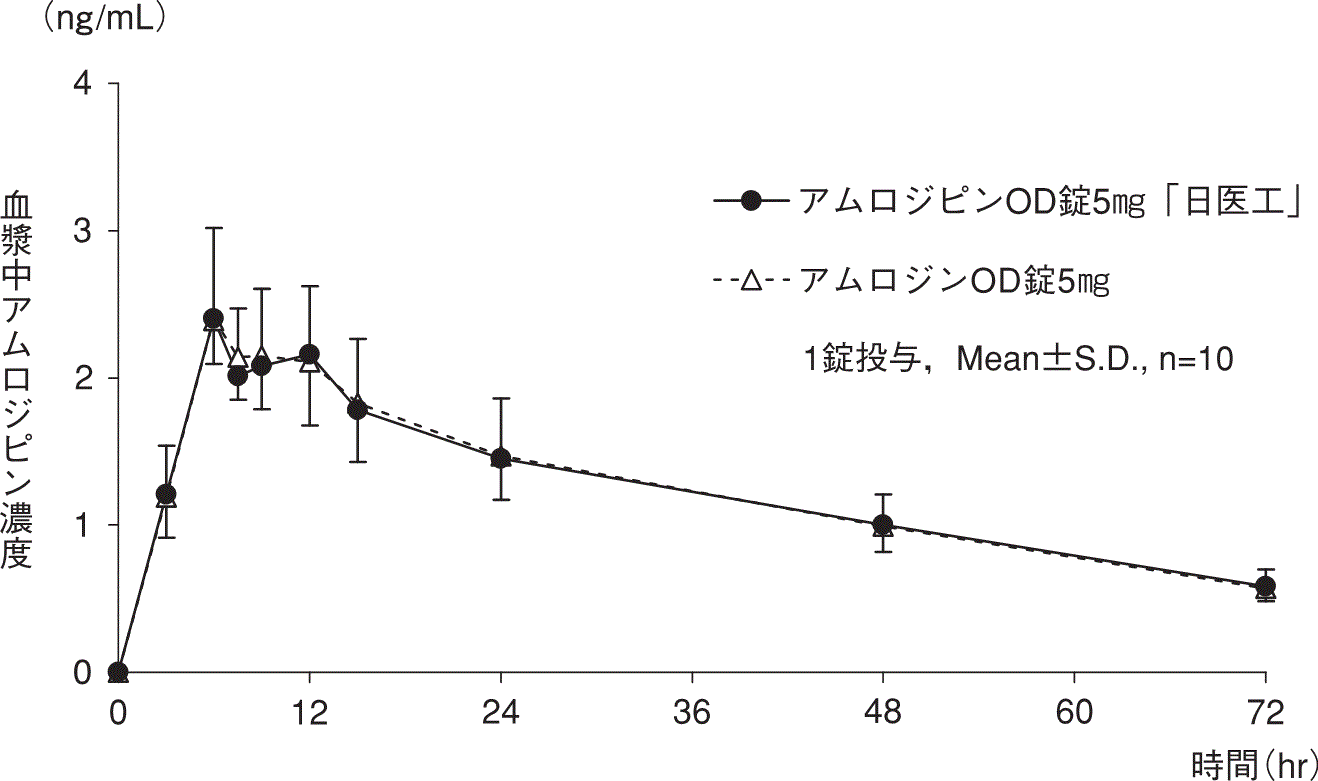
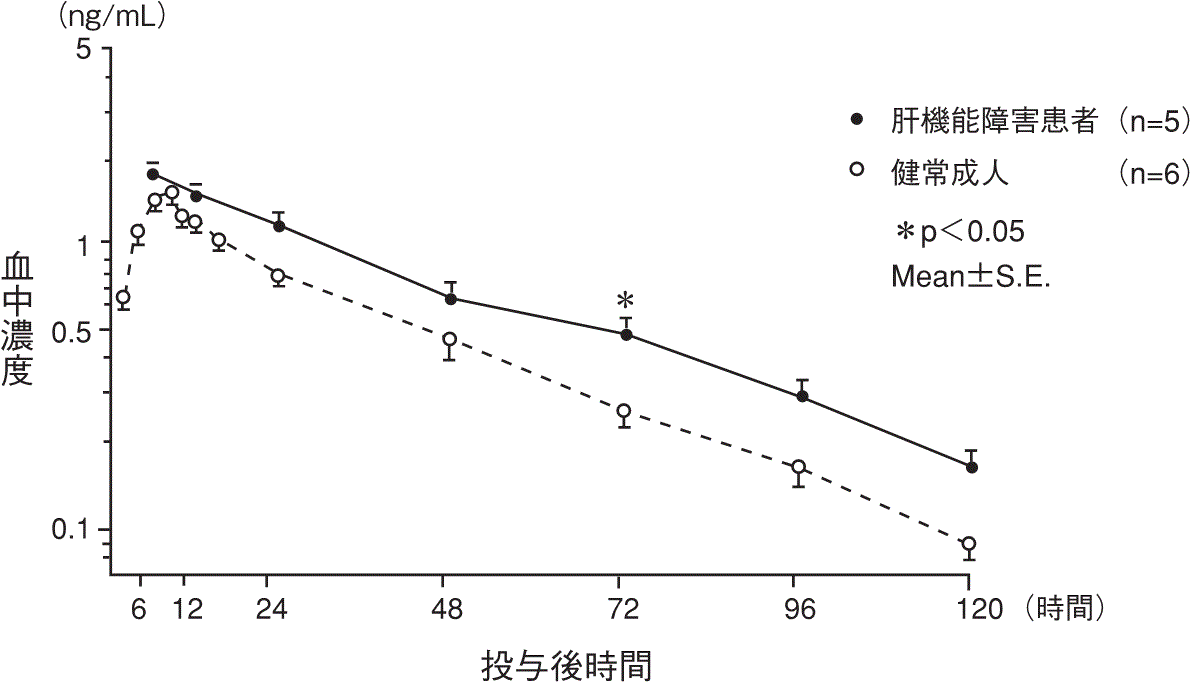
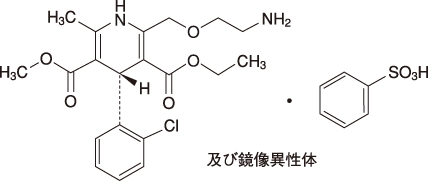
1
堀本政夫 他:応用薬理. 1991;42(2):167-176
2
Naito T., et al.:J. Hum. Lact. 2015;31(2):301-306
3
桑島巌 他:Geriatric Medicine. 1991;29(6):899-902
4
Laine K., et al.:Br. J. Clin. Pharmacol. 1997;43(1):29-33
5
健康成人におけるアムロジピン10mg単回投与時の安全性と薬物動態(ノルバスク錠:2009年2月23日承認、審査報告書)
6
中島光好 他:臨床医薬. 1991;7(7):1407-1435
7
田中孝典 他:医学と薬学. 2008;59(4):555-564
8
藤田雅巳 他:医学と薬学. 2009;62(3):555-569
9
浦江隆次 他:薬理と治療. 1991;19(7):2933-2942
10
分布(ユニシア配合錠:2010年4月16日承認、申請資料概要2.6.4.4)
11
Beresford A. P., et al.:Xenobiotica. 1988;18(2):245-254
12
足立幸彦 他:薬理と治療. 1991;19(7):2923-2932
13
Flynn J. T., et al.:J. Clin. Pharmacol. 2006;46(8):905-916
14
社内資料:生物学的同等性試験(錠10mg)
15
社内資料:生物学的同等性試験(OD錠10mg)
16
増山善明 他:薬理と治療. 1991;19(7):2853-2871
17
増山善明 他:薬理と治療. 1991;19(7):2873-2893
18
増山善明 他:薬理と治療. 1991;19(7):2895-2908
19
増山善明 他:臨床評価. 1991;19(2):213-241
20
猿田享男 他:薬理と治療. 1993;21(2):505-526
21
山田和生 他:薬理と治療. 1991;19(8):3189-3203
22
アムロジピンの高血圧症に対する有効性および安全性(カデュエット配合錠:2009年7月7日承認、申請資料概要2.7.3.4)
23
Fujiwara T., et al.:J. Hum. Hypertens. 2009;23(8):521-529
24
アムロジピン5mgで効果不十分な患者に対するアムロジピン10mgの長期投与試験ノルバスク錠・OD錠、アムロジン錠・OD錠:2009年2月23日承認、審査報告書)
25
中島譲 他:薬理と治療. 1991;19(8):3205-3219
26
第十八改正日本薬局方解説書 廣川書店 2021;C306-C311
27
山中教造 他:日本薬理学雑誌. 1991;97(3):167-178
28
山中教造 他:日本薬理学雑誌. 1991;97(2):115-126
29
Fleckenstein A., et al.:Am. J. Cardiol. 1989;64(17):21Ⅰ-34Ⅰ
30
Suzuki M., et al.:Eur. J. Pharmacol. 1993;228(5-6):269-274
31
Nayler W. G., et al.:Am. J. Cardiol. 1989;64(17):65Ⅰ-70Ⅰ
32
田村裕男 他:薬理と治療. 1990;18(Suppl.2):S339-S345





 555
555

 557
557