1
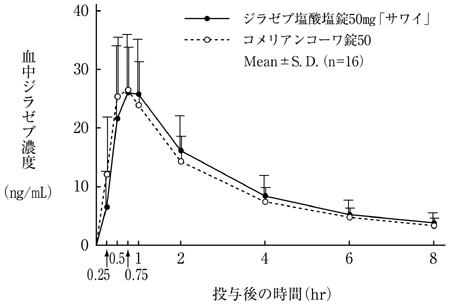
社内資料:生物学的同等性試験(錠50mg)
2
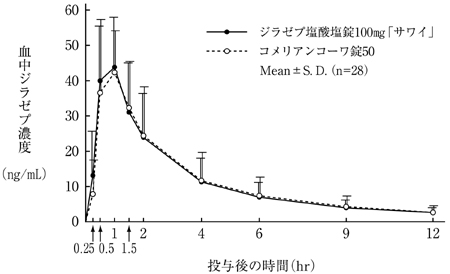
社内資料:生物学的同等性試験(錠100mg)
3
鈴木ひとみ他:薬理と治療, 1982;10:2175-2179
4
Sumiyoshi, A. et al.:Thromb. Res., 1981;23:381-386
5
竹田晴生他:動脈硬化, 1984;12:1007-1012
6
武永美津子他:動脈硬化, 1984;12:363-370
7
Inage, H. et al.:日本腎臓学会誌, 1985;27:1253-1260
8
Inage, H. et al.:日本腎臓学会誌, 1985;27:1261-1270
9
Nagase, M. et al.:日本腎臓学会誌, 1985;27:385-391