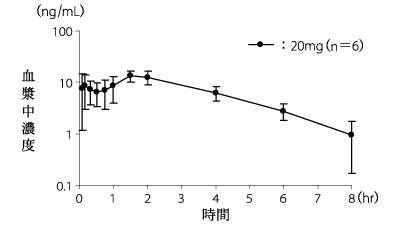
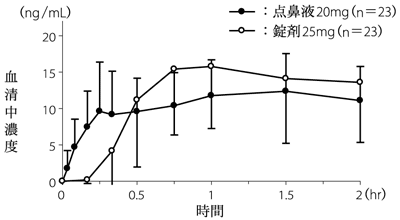
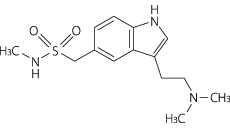
1
International Headache Society:Cephalalgia.2018;38:1-211
2
Wojnar-Horton RE,et al.:Br J Clin Pharmacol.1996;41:217-221
3
Duquesnoy C,et al.:Eur J Pharm Sci.1998;6:99-104
4
Tarbit MH,et al.:Biochem Pharmacol.1994;47:1253-1257
5
Williams P,et al.:Cephalalgia.1997;17:408
6
Scott AK,et al.:Br J Clin Pharmacol.1991;32:581-584
7
Van Hecken AM,et al.:Br J Clin Pharmacol.1992;34:82-84
8
Connor HE,et al.:Br J Pharmacol.1989;96:379-387
9
Parsons AA,et al.:Br J Pharmacol.1989;96:434-449
10
Humphrey PPA,et al.:Serotonin:Molecular Biology,Receptors and Functional Effects.Basel:Birkhauser Verlag,1991;421-429
11
Jansen I,et al.:Cephalalgia.1992;12:202-205
12
後藤好史ほか:基礎と臨床.1993;27:3609-3630
13
Caekebeke JFV,et al.:Neurology.1992;42:1522-1526
14
Goadsby PJ,et al.:Ann Neurol.1993;33:48-56
15
McCarthy BG,et al.:Headache.1989;29:420-422
16
後藤好史ほか:基礎と臨床.1993;27:3593-3607
17
Humphrey PPA,et al.:Br J Pharmacol.1988;94:1123-1132
18
Connor HE,et al.:Eur J Pharmacol.1989;161:91-94