1
International Headache Society:Cephalalgia.2018;38:1-211
2
Wojnar-Horton RE,et al.:Br J Clin Pharmacol.1996;41:217-221
3
単回投与(イミグラン錠:2001年6月20日承認、申請資料概要へ.3.1.1.1)
4
薬物動態の比較(イミグラン錠:2001年6月20日承認、申請資料概要へ.3.4.)
5
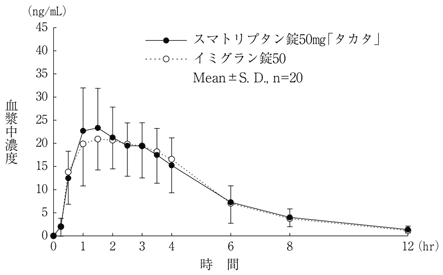
社内資料:生物学的同等性試験(スマトリプタン錠50mg「タカタ」)
6
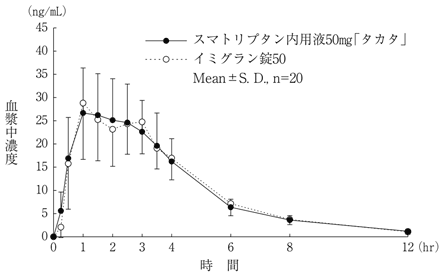
社内資料:生物学的同等性試験(スマトリプタン内用液50mg「タカタ」)
7
Tarbit MH,et al.:Biochem Pharmacol.1994;47:1253-1257
8
排泄(単回投与)(イミグラン錠:2001年6月20日承認、申請資料概要へ.3.1.3.1)
9
肝機能障害患者における成績(イミグラン錠:2001年6月20日承認、申請資料概要へ.3.2.)
10
Williams P,et al.:Cephalalgia.1997;17:408
11
Fujita M,et al.:Cephalalgia.2014;34(5):365-375
12
Connor HE,et al.:Br J Pharmacol.1989;96:379-387
13
Parsons AA,et al.:Br J Pharmacol.1989;96:434-449
14
Humphrey PPA,et al.:Serotonin:Molecular Biology,Receptors and Functional Effects.Basel:Birkhauser Verlag,1991;421-429
15
Jansen I,et al.:Cephalalgia.1992;12:202-205
16
後藤好史ほか:基礎と臨床.1993;27:3609-3630
17
Caekebeke JFV,et al.:Neurology.1992;42:1522-1526
18
後藤好史ほか:基礎と臨床.1993;27:3593-3607
19
Goadsby PJ,et al.:Ann Neurol.1993;33:48-56