1
阿部真也他:周産期医学, 2017;47:1353-1355
2
齊藤大祐他:鹿児島産科婦人科学会雑誌, 2021;29:49-54
3
Sheps, S. G. et al.:Arch. Intern. Med., 1997;157(21):2413-2446
4
Briggs, G. G. et al.:Ann. Pharmacother., 2001;35(7-8):859-861
5
Cooper, W. O. et al.:N. Engl. J. Med., 2006;354(23):2443-2451
6
Rai, A. et al.:Am. J. Respir. Crit. Care Med., 2016;193:A1890
7
Jansson, P. S. et al.:J. Emerg. Med., 2018;55:836-840
8
Vadas, P.:Am. J. Emerg. Med., 2020;38:1299.e1-1299.e2
9
Kane, S. P. et al.:Perfusion, 2018;33:320-322
10
Pottegard, A. et al.:J. Intern. Med., 2017;282(4):322-331
11
Pedersen, S. A. et al.:J. Am. Acad. Dermatol., 2018;78(4):673-681
12
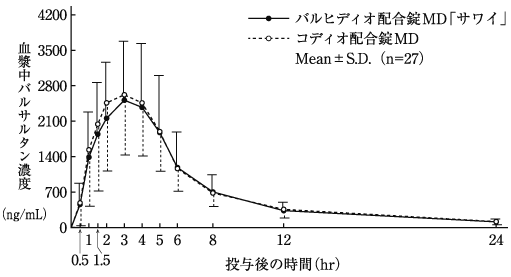
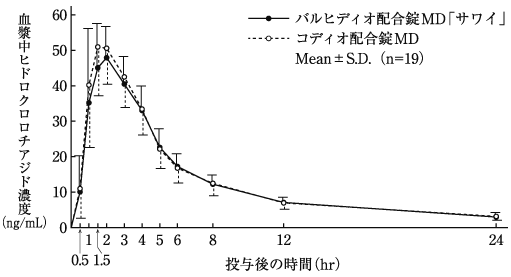
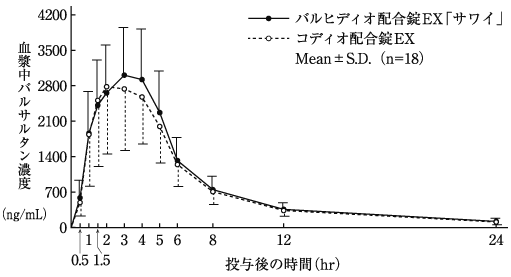
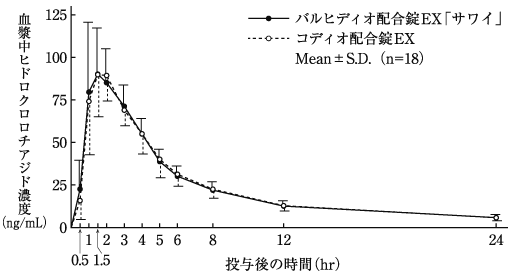
配合剤投与時と単剤併用時の生物学的同等性の検討(コディオ配合錠:2009年1月21日承認、申請資料概要2.7.6-1.2.2)
13
髙野和彦他:診療と新薬, 2016;53(10):854-867
14
薬物動態に対する食事の影響(コディオ配合錠:2009年1月21日承認、申請資料概要2.7.6-1.1.1)
15
Colussi, D. M. et al.:J. Clin. Pharmacol., 1997;37(3):214-221
16
髙折修二他監訳:グッドマン・ギルマン薬理書, 第12版, 廣川書店, 2013;2504
17
Waldmeier, F. et al.:Xenobiotica, 1997;27(1):59-71
18
Nakashima, A. et al.:Xenobiotica, 2005;35(6):589-602
19
Beermann, B. et al.:Clin. Pharmacol. Ther., 1976;19(5 Pt1):531-537
20
バルサルタンとヒドロクロロチアジドの薬物間相互作用の検討(コディオ配合錠:2009年1月21日承認、申請資料概要2.7.6-3.1.1)
21
川名正敏:新薬と臨牀, 2009;58(4):583-596
22
第十八改正日本薬局方解説書, 廣川書店, 2021;C-4116-4122
23
第十八改正日本薬局方解説書, 廣川書店, 2021;C-4338-4343
24
効力を裏付ける試験(コディオ配合錠:2009年1月21日承認、申請資料概要2.6.2-6.1)
25
高血圧自然発症ラットを用いたバルサルタンとヒドロクロロチアジドの併用投与による降圧効果(コディオ配合錠:2009年1月21日承認、申請資料概要2.6.2-2.1.1)