1
阿部真也他:周産期医学, 2017;47:1353-1355
2
齊藤大祐他:鹿児島産科婦人科学会雑誌, 2021;29:49-54
3
健康成人男性における単回投与試験(アバプロ錠:2008年4月16日承認、申請資料概要2.7.2.2, 2.7.6.3)
4
健康成人での反復投与試験(50mg)(アバプロ錠:2008年4月16日承認、申請資料概要2.7.6.3)
5
健康成人での反復投与試験(100mg)(アバプロ錠:2008年4月16日承認、申請資料概要2.7.6.3)
6
本態性高血圧症患者における薬物動態試験(アバプロ錠:2018年3月29日再審査報告書)
7
高野和彦他:診療と新薬, 2017;54(10):954-965
8
蛋白結合率(アバプロ錠:2008年4月16日承認、申請資料概要2.7.2.2)
9
ヒト肝ミクロソームを用いた酸化代謝におけるCYP2C9の関与(アバプロ錠:2008年4月16日承認、申請資料概要2.6.5.10)
10
グルクロン酸抱合の種差(アバプロ錠:2008年4月16日承認、申請資料概要2.6.5.10)
11
ヒト肝ミクロソームを用いたCYP阻害の検討(アバプロ錠:2008年4月16日承認、申請資料概要2.6.5.12)
12
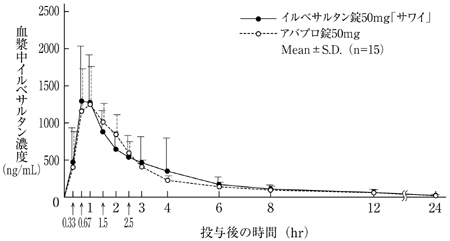
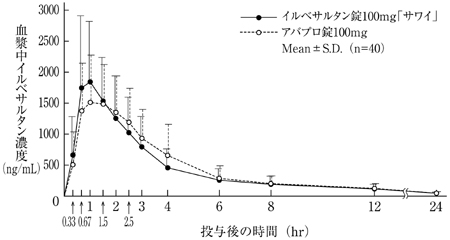
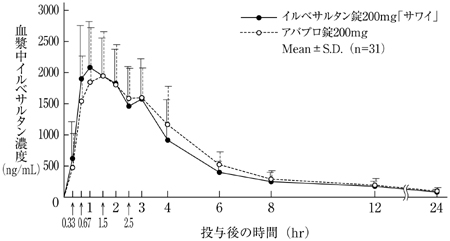
バイオアベイラビリティ試験(アバプロ錠:2008年4月16日承認、申請資料概要2.7.6.1)
13
腎機能障害患者における薬物動態試験(アバプロ錠:2008年4月16日承認、申請資料概要2.7.6.3)
14
肝硬変患者における薬物動態試験(アバプロ錠:2008年4月16日承認、申請資料概要2.7.6.3)
15
高齢者における薬物動態試験(アバプロ錠:2008年4月16日承認、申請資料概要2.7.6.3)
16
ワルファリンとの薬物相互作用試験(1)(アバプロ錠:2008年4月16日承認、申請資料概要2.7.6.3)
17
ワルファリンとの薬物相互作用試験(2)(アバプロ錠:2008年4月16日承認、申請資料概要2.7.6.3)
18
国内臨床試験(アバプロ錠:2008年4月16日承認、申請資料概要2.7.3.3, 2.7.6.6)
19
吉永馨他:血圧, 2011;18:1108-1116
20
ウサギ摘出大動脈における作用(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.2)
21
AII誘発昇圧反応に対する作用(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.2)
22
AII受容体に対する拮抗様式の検討(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.2)
23
AII受容体サブタイプに対する選択性(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.2)
24
各種受容体及びイオン輸送系に対する作用(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.3)
25
各種酵素に対する作用(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.3)
26
高レニン正常血圧サルにおける作用(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.2)
27
2腎性1クリップ型高血圧ラットにおける作用(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.2)
28
脳卒中易発症性高血圧自然発症ラットにおける作用(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.2)
29
高血圧自然発症ラットにおける作用(アバプロ錠:2008年4月16日承認、申請資料概要2.6.2.2)