1
Oi, A. et al.:Cardiovasc. Drugs Ther., 2011;25(Suppl.1):S91-S99
2
Furukawa, M. et al.:Cardiovasc. Drugs Ther., 2011;25(Suppl.1):S83-S89
3
Torres, V. E. et al.:N. Engl. J. Med., 2012;367(25):2407-2418
4
Kim, S. R. et al.:Cardiovasc. Drugs Ther., 2011;25(Suppl.1):S5-S17
5
心性浮腫患者における臨床薬理試験(サムスカ錠:2010年10月27日承認、申請資料概要2.7.6.5)
6
肝性浮腫患者における臨床薬理試験(サムスカ錠:2013年9月13日承認、申請資料概要2.7.6.4)
7
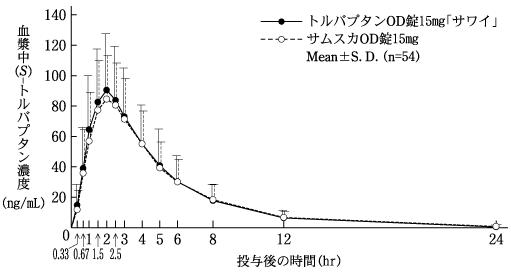
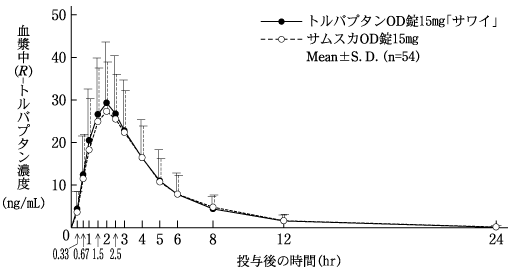
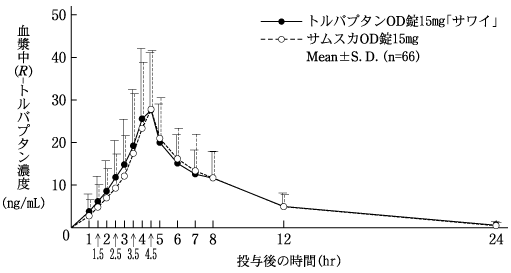
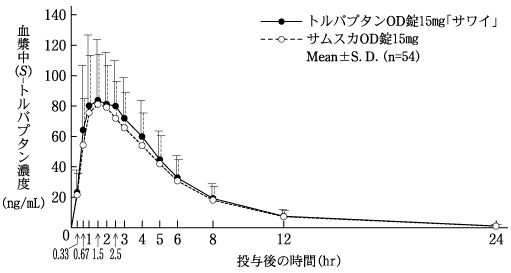
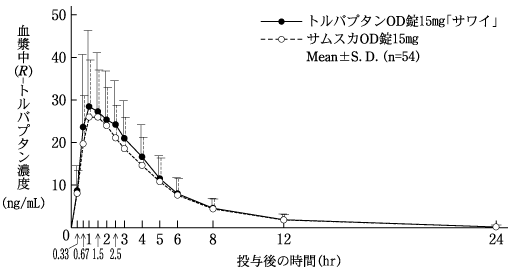
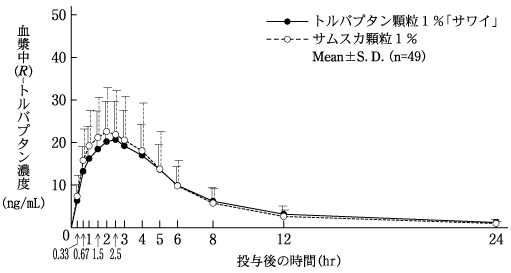
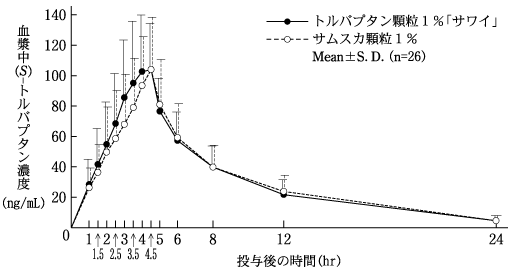
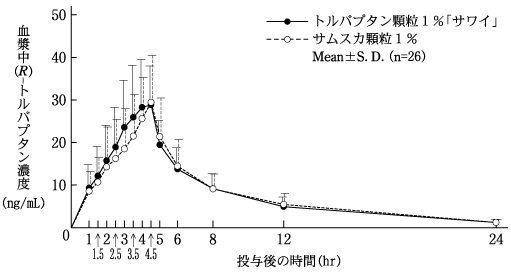
社内資料:生物学的同等性試験(OD錠15mg)
8
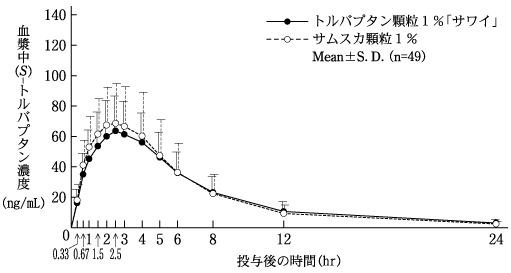
社内資料:生物学的同等性試験(顆粒1%)
9
Shoaf, S. E. et al.:Int. J. Clin. Pharmacol. Ther., 2012;50(2):150-156
10
ヒトにおける推定代謝経路(サムスカ錠:2010年10月27日承認、申請資料概要2.7.2.2)
11
吸収、分布、代謝、排泄試験(サムスカ錠:2010年10月27日承認、申請資料概要2.7.6.3)
12
Shoaf, S. E. et al.:Kidney Int., 2014;85(4):953-961
13
肝性浮腫患者を対象とした母集団薬物動態解析(サムスカ錠:2010年10月27日承認、申請資料概要2.7.2.3)
14
年齢、性別による影響(サムスカ錠:2010年10月27日承認、申請資料概要2.7.6.3)
15
Shoaf, S. E. et al.:Br. J. Clin. Pharmacol., 2011;73(4):579-587
16
FDA Center for Drug Evaluation and Research:Application No. 204441Orig1s000:Clinical Pharmacology Review
17
Shoaf, S. E. et al.:Eur. J. Clin. Pharmacol., 2012;68(2):207-211
18
Shoaf, S. E. et al.:J. Clin. Pharmacol., 2011;51(5):761-769
19
ロバスタチンとの相互作用1(サムスカ錠:2010年10月27日承認、申請資料概要2.7.6.3)
20
ロバスタチンとの相互作用2(サムスカ錠:2010年10月27日承認、申請資料概要2.7.6.2)
21
Shoaf, S. E. et al.:J. Cardiovasc. Pharmacol. Ther., 2005;10(3):165-171
22
Shoaf, S. E. et al.:Clinical Pharmacology in Drug Development, 2012;1(2):67-75
23
Shoaf, S. E. et al.:J. Cardiovasc. Pharmacol., 2007;50(2):213-222
24
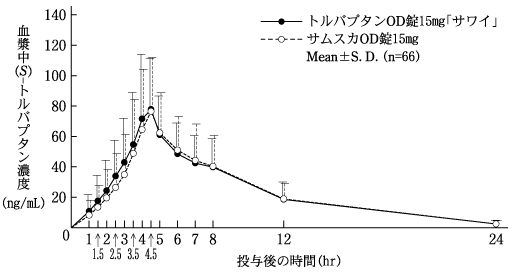
社内資料:生物学的同等性試験(OD錠7.5mg)
25
Matsuzaki, M. et al.:Cardiovasc. Drugs Ther., 2011;25(Suppl.1):S33-S45
26
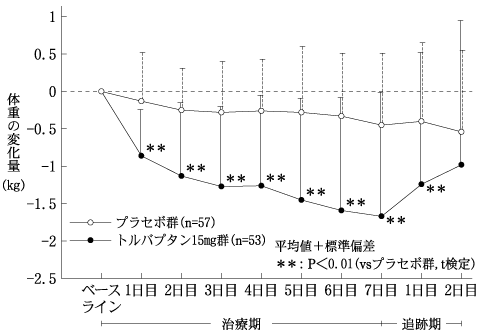
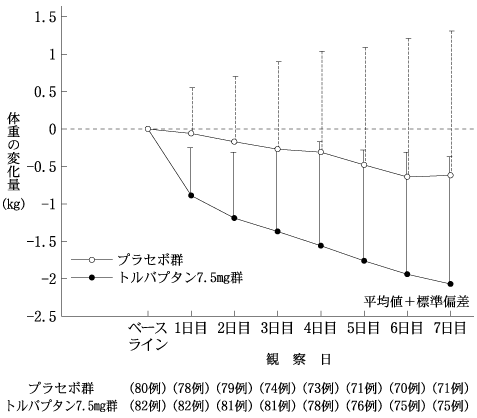
うっ血性心不全患者を対象としたプラセボとの二重盲検比較試験(サムスカ錠:2010年10月27日承認、申請資料概要2.7.6.5)
27
肝性浮腫患者におけるプラセボを対照とした二重盲検比較試験(サムスカ錠:2013年9月13日承認、申請資料概要2.7.6.4)
28
作用機序(サムスカ錠:2010年10月27日承認、申請資料概要2.6.1.2)
29
Yamamura, Y. et al.:J. Pharmacol. Exp. Ther., 1998;287(3):860-867
30
Miyazaki, T. et al.:Cardiovasc. Drug Rev., 2007;25(1):1-13
31
Hirano, T. et al.:J. Pharmacol. Exp. Ther., 2000;292(1):288-294
32
Miyazaki, T. et al.:Cardiovasc. Drugs Ther., 2011;25(Suppl.1):S77-S82
33
Onogawa, T. et al.:Cardiovasc. Drugs Ther., 2011;25(Suppl.1):S67-S76
34
Miyazaki, T. et al.:Hepatol. Res., 2013;43(11):1224-1230