1
毒性試験(ナゾネックス点鼻液:2008年7月16日承認、申請資料概要2.6.6.1)
2
後藤 穣ほか:日鼻誌 2018, 57 (1), 7-16
3
Kamei C, et al.:Jpn Pharmacol Ther 1995, 23 (11), 2979-2982
4
Sugimoto Y, et al.:Pharmacology 2000, 61 (2), 91-95
定量噴霧式アレルギー性鼻炎治療剤
1瓶 933.4円
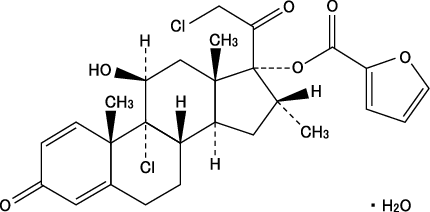
有効成分 | モメタゾンフランカルボン酸エステル水和物 分量注) 1g中 0.5mg |
|---|---|
有効成分 | モメタゾンフランカルボン酸エステル水和物 分量注) 1回噴霧中 50μg |
有効成分 | モメタゾンフランカルボン酸エステル水和物 1容器の噴霧回数 56回 |
添加剤 | ベンザルコニウム塩化物、ポリソルベート80、カルボキシビニルポリマー、濃グリセリン、L-アルギニン、塩化ナトリウム、エデト酸ナトリウム水和物、エタノール、pH調節剤 |
有効成分 | モメタゾンフランカルボン酸エステル水和物 分量注) 1g中 0.5mg |
|---|---|
有効成分 | モメタゾンフランカルボン酸エステル水和物 分量注) 1回噴霧中 50μg |
有効成分 | モメタゾンフランカルボン酸エステル水和物 1容器の噴霧回数 112回 |
添加剤 | ベンザルコニウム塩化物、ポリソルベート80、カルボキシビニルポリマー、濃グリセリン、L-アルギニン、塩化ナトリウム、エデト酸ナトリウム水和物、エタノール、pH調節剤 |
| 剤形 | 定量噴霧式の点鼻製剤 |
|---|---|
| 性状 | 白色懸濁性の粘稠な液で、ほとんどにおいはない |
| 剤形 | 定量噴霧式の点鼻製剤 |
|---|---|
| 性状 | 白色懸濁性の粘稠な液で、ほとんどにおいはない |
1~5%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | じん麻疹等の発疹 | ||
鼻腔 | 鼻症状(刺激感注)、そう痒感、乾燥感注)、疼痛、発赤、不快感注)等)、真菌検査陽性 | 鼻出血注)、鼻漏、鼻閉、くしゃみ、嗅覚障害 | 鼻中隔穿孔、鼻潰瘍、鼻症状(灼熱感) |
口腔並びに呼吸器 | 咽喉頭症状(刺激感、疼痛、不快感、乾燥等) | 咳嗽、上気道炎 | |
肝臓 | 肝機能障害、ALT上昇注)、AST上昇注)、ビリルビン上昇、Al-P上昇、ウロビリン尿 | ||
血液 | 好中球増多、好酸球増多、単球増多、白血球減少、白血球増多、白血球分画異常、赤血球減少注)、ヘモグロビン減少注)、ヘマトクリット減少注)、リンパ球減少、血小板減少注)、カリウム上昇 | ||
精神神経系 | 頭痛、倦怠感 | ||
眼 | 眼圧亢進、霧視、中心性漿液性網脈絡膜症 | ||
その他 | コルチゾール減少注) | 蛋白尿注)、尿糖、BUN上昇、コルチゾール上昇 | 味覚障害 |
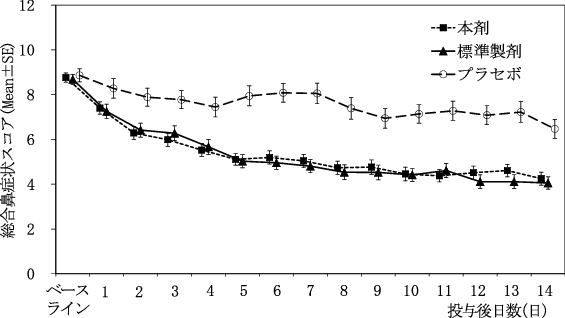
投与群 | 症例数 | ベースライン Mean (S.D.) | 変化量 平均値の推定値注2) (95%信頼区間) | 解析結果注2) |
本剤 | 72 | 8.764 (1.754) | -4.297 (-4.841~-3.753) | 平均値の差の推定値 (本剤–標準製剤) :0.342 95%信頼区間 :-0.427~1.112 |
標準製剤 | 72 | 8.685 (1.869) | -4.639 (-5.184~-4.095) | |
プラセボ | 36 | 8.861 (1.746) | -1.859 (-2.628~-1.089) | - |