1
興和(株)社内資料: 臨床薬理試験(2022年9月26日承認、CTD2.7.6.1)
2
興和(株)社内資料: 非臨床試験 薬物動態試験(2022年9月26日承認、CTD2.6.4.1-10)
3
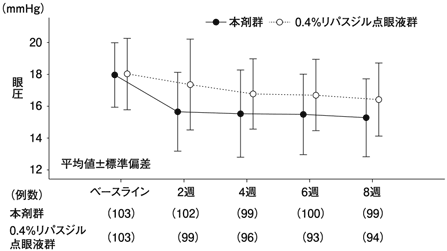
興和(株)社内資料: 国内第Ⅲ相リパスジル点眼液対照比較試験(2022年9月26日承認、CTD2.7.6.2)
4
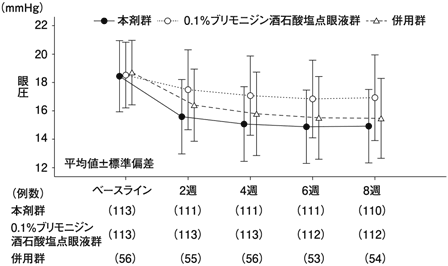
興和(株)社内資料: 国内第Ⅲ相ブリモニジン点眼液対照比較試験(2022年9月26日承認、CTD2.7.6.3)
5
興和(株)社内資料: 非臨床試験 薬理試験(グラナテック点眼液0.4%:2014年9月26日承認、CTD2.6.2.1-8)
6
Burke J, et al.: Surv Ophthalmol. 1996; 41 Suppl 1: S9-18.
7
Toris CB, et al.: Arch Ophthalmol. 1995; 113: 1514-7.
8
興和(株)社内資料: 非臨床試験 薬理試験(2022年9月26日承認、CTD2.6.2.1-8)