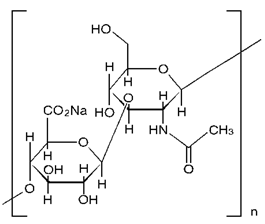
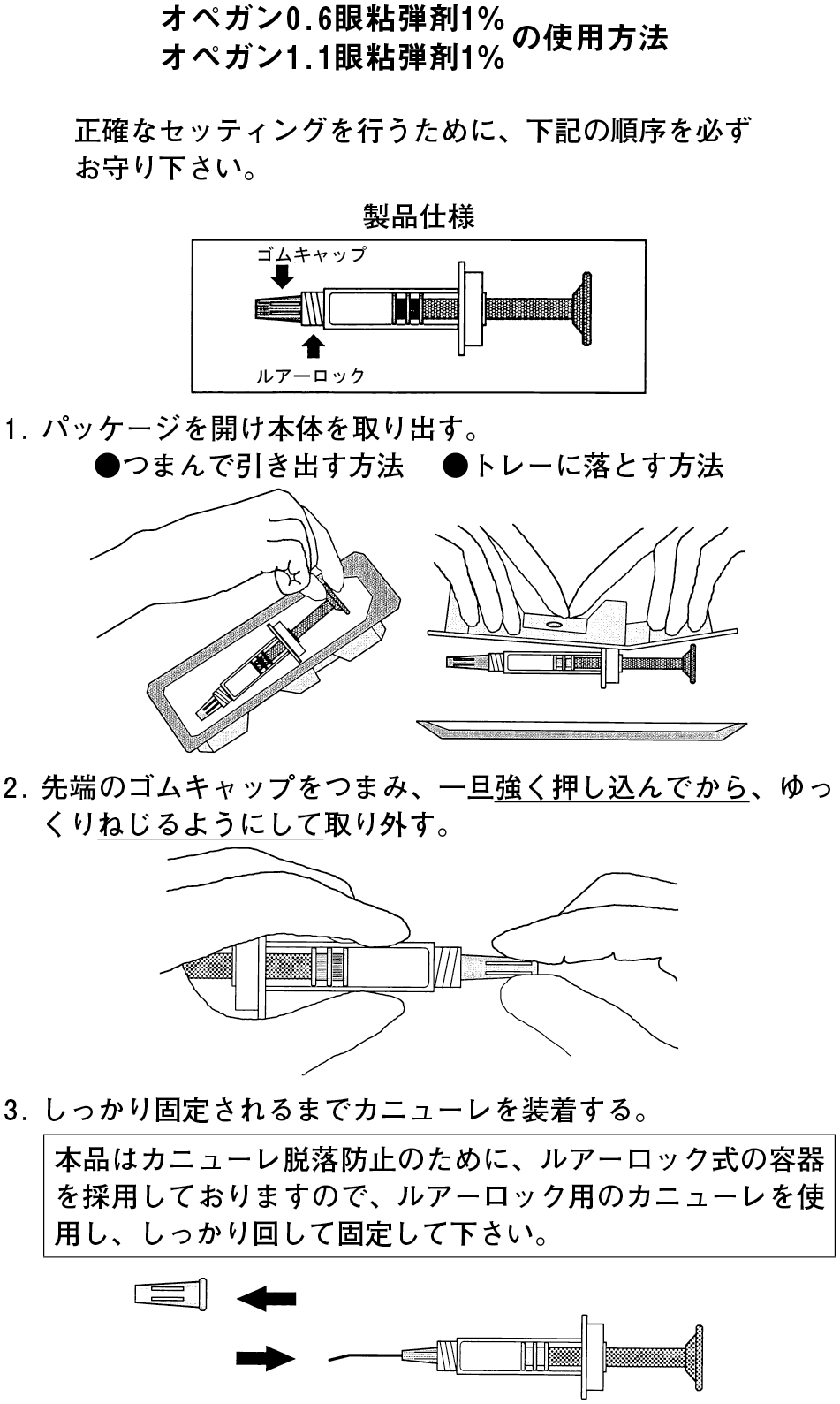
1
松本順三, 他: 日本眼科紀要. 1985; 36: 412-417.〔52679〕
2
松本順三, 他: 日本眼科紀要. 1985; 36: 622-624.〔52680〕
3
Miyauchi S., et al.: Curr. Eye Res.. 1984; 3: 611-617.〔52681〕
4
Iwata S., et al.: Jpn. J. Ophthalmol.. 1985; 29: 187-197.〔52682〕
5
坂本 崇, 他: 応用薬理. 1984; 28: 421-431.〔52688〕
6
清水公也, 他: 新薬と臨床. 1996; 45: 519-538.〔52690〕
7
清水公也, 他: 新薬と臨床. 1996; 45: 539-549.〔52691〕
8
北野周作, 他: 眼科臨床医報. 1985; 79: 564-598.〔52656〕
9
Miyauchi S., et al.: J. Ocul. Pharmacol.. 1986; 2: 267-274.〔52657〕
10
Miyauchi S., et al.: Curr. Eye Res.. 1984; 3: 1063-1067.〔52659〕
11
Miyauchi S., et al.: J. Ocul. Pharmacol.. 1996; 12: 27-34.〔52707〕
12
生化学工業(株)社内資料: 角膜内皮傷害に対するヒアルロン酸ナトリウムの保護効果(向野豊法, 他. 1995年)〔52708〕