作成又は改訂年月
日本標準商品分類番号
薬効分類名
承認等
販売名
ヒーロン眼粘弾剤1%シリンジ0.4mL
販売名コード
承認・許可番号
23000AMX00202000
Healon Ophthalmic Viscoelastic Substance 1% syringe 0.4mL
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
凍結を避け、2〜8℃で遮光保存
使用期限
外箱に記載(製造から3年)
組成
有効成分(含量)
[1製剤(0.4mL)中]
日局 精製ヒアルロン酸ナトリウム(4mg)
添加物
塩化ナトリウム、リン酸水素二ナトリウム水和物、リン酸二水素ナトリウム、pH調節剤
性状
| 性状 | 無色澄明な粘稠性のある液 |
|---|
| pH | 7.1〜7.6 |
|---|
| 粘度 | 80〜200(Pa・s) |
|---|
| 浸透圧比 | 0.9〜1.3(生理食塩液に対する比) |
|---|
販売名
ヒーロン眼粘弾剤1%シリンジ0.6mL
販売名コード
承認・許可番号
23000AMX00203000
Healon Ophthalmic Viscoelastic Substance 1% syringe 0.6mL
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
凍結を避け、2〜8℃で遮光保存
使用期限
外箱に記載(製造から3年)
組成
有効成分(含量)
[1製剤(0.6mL)中]
日局 精製ヒアルロン酸ナトリウム(6mg)
添加物
塩化ナトリウム、リン酸水素二ナトリウム水和物、リン酸二水素ナトリウム、pH調節剤
性状
| 性状 | 無色澄明な粘稠性のある液 |
|---|
| pH | 7.1〜7.6 |
|---|
| 粘度 | 80〜200(Pa・s) |
|---|
| 浸透圧比 | 0.9〜1.3(生理食塩液に対する比) |
|---|
販売名
ヒーロン眼粘弾剤1%シリンジ0.85mL
販売名コード
承認・許可番号
23000AMX00204000
Healon Ophthalmic Viscoelastic Substance 1% syringe 0.85mL
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
凍結を避け、2〜8℃で遮光保存
使用期限
外箱に記載(製造から3年)
組成
有効成分(含量)
[1製剤(0.85mL)中]
日局 精製ヒアルロン酸ナトリウム(8.5mg)
添加物
塩化ナトリウム、リン酸水素二ナトリウム水和物、リン酸二水素ナトリウム、pH調節剤
性状
| 性状 | 無色澄明な粘稠性のある液 |
|---|
| pH | 7.1〜7.6 |
|---|
| 粘度 | 80〜200(Pa・s) |
|---|
| 浸透圧比 | 0.9〜1.3(生理食塩液に対する比) |
|---|
一般的名称
原則禁忌
本剤の成分又は蛋白系薬剤に対し過敏症の既往歴のある患者
効能又は効果
白内障手術・眼内レンズ挿入術・全層角膜移植術における手術補助
用法及び用量
○白内障手術・眼内レンズ挿入術を連続して施行する場合には、通常0.2〜0.75mLを前房内へ注入する。また、眼内レンズのコーティングに約0.1mL使用する。ただし、白内障手術又は眼内レンズ挿入術のみを施行する場合には、以下のとおりとする。
白内障手術:通常0.1〜0.4mLを前房内へ注入する。
眼内レンズ挿入術:眼内レンズ挿入前に、通常0.1〜0.5mLを前房内へ注入する。また、眼内レンズのコーティングに約0.1mL使用する。
○全層角膜移植術:移植眼の角膜片を除去後に、通常0.1〜0.6mLを前房内へ注入し、移植片角膜を本剤上に浮遊させて縫合を行う。また、提供眼の移植片角膜のコーティングに約0.1mL使用する。
使用上の注意
重要な基本的注意
注意深く、ゆっくりと注入すること。
過量に注入しないこと(術後の眼圧上昇の原因となる可能性がある)。
超音波乳化吸引術を行う前に吸引灌流を行い、水晶体と本剤との間に灌流液で満たした空間を作ること(空間が不十分なまま超音波乳化吸引を行うとチップの閉塞により、灌流不全となり角膜熱傷を起こすことがある)。
特に手術直後は、注意深く眼圧を観察すること。もし眼圧上昇があらわれた場合は適切な処置を行うこと。
手術後、できるだけ洗浄等により本剤を除去することが望ましい。
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
その他の副作用
以下のような副作用が現れた場合、症状に応じて適切な処置を行うこと。
眼
眼圧上昇、炎症反応、嚢胞様黄斑浮腫、角膜浮腫、角膜混濁、前房出血、虹彩新生血管、虹彩後癒着、結膜癒着不全、散瞳、水晶体混濁、浅前房、疼痛、霧視、かゆみ
その他
眼内レンズ表面の混濁
適用上の注意
投与経路
本剤は眼科用剤として、用法・用量にしたがって投与し、血管内へは投与しないこと。
投与時
本剤は冷所に保存するので、投与に先立って室温に30分以上保つことが望ましい。
本剤の使用にあたっては、ルアーロック式のカニューレを使用し、カニューレがシリンジに完全に装着したことを確認してから使用すること。装着が完全でないと、使用中にカニューレが外れ重大な事故が起こるおそれがある。
本剤の有効成分である精製ヒアルロン酸ナトリウムは、ベンザルコニウム塩化物等の第4級アンモニウム塩及びクロルヘキシジンにより沈殿を生じることがあるので十分注意すること。
本剤の開封後の使用は1回限りとし、残液は容器とともに廃棄すること。
薬物動態
[参考]1)
ウサギの眼球の前房内に投与したヒアルロン酸ナトリウムは、低分子化されることなく48時間後にはほぼ100%が前房隅角から消失する。
血中に移行したヒアルロン酸は主に肝臓で単糖に代謝され、その後糖蛋白質合成に再利用されるものと、二酸化炭素に分解されるものがあると考えられた。
臨床成績
先発製剤(ヒーロン)における比較臨床試験の結果、白内障手術、眼内レンズ挿入術、全層角膜移植術に対する本剤の投与は、手術を容易にし、術後経過も良好でその有用性は対照群との間に有意差をもって認められた。試験成績の概要は次のとおりである。2〜5)
白内障手術・眼内レンズ挿入術(連続施行)
全国16施設174例につき白内障手術に先発製剤を使用しない群を対照として実施された。白内障手術に嚢外摘出術あるいは超音波乳化吸引術を用いた先発製剤投与群の有用率はそれぞれ81.4%(35/43)あるいは95.6%(43/45)であった。
眼内レンズ挿入術
全国13施設総計293例につき主に空気を対照として実施された。先発製剤投与群の有用率は98.8%(161/163)であった。
全層角膜移植術
全国35施設60例につきリンゲル液を対照として実施された。先発製剤投与群の有用率は90.6%(29/32)であった。
薬効薬理
前房形成効果6,7)
ブタ摘出眼球を用い、先発製剤(ヒーロン0.6眼粘弾剤1%)を対照とし前房形成試験を実施した。製剤注入時から水晶体乳化吸引除去後までの各段階において、前房深度は対照群と同等であり、十分な前房形成効果を確認した。
(表1参照)
角膜内皮保護作用6,7)
ユカタンミニブタ(n=6)で右眼・本剤、左眼・先発製剤(ヒーロン0.6眼粘弾剤1%)を用いた眼内レンズ挿入術を実施し、角膜内皮細胞保護効果を検証した。術後14日までの経過観察において、試験全体で角膜内皮細胞数、角膜厚及び細胞密度に関して、明らかな左右差はみられず、本剤は先発製剤と同等の角膜内皮保護効果を有することを確認した。
前房形成効果及び角膜内皮保護効果の機序6,7)
前房形成についてはヒアルロン酸ナトリウムの高い粘稠性に基づくと考えられ、また角膜内皮保護効果についてもその高い粘稠性が一種の潤滑剤として働いていることに基づくと考えられる。
薬効薬理の表
| | 注入後 | 水晶体除去後 |
| 本剤 n=10 | 115.28±12.58 | 82.23±5.70 |
| 先発製剤 n=3 | 114.77±8.27 | 79.47±6.36 |
有効成分に関する理化学的知見
一般名
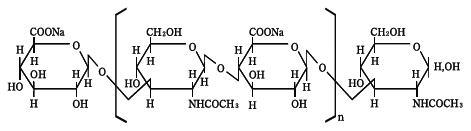
精製ヒアルロン酸ナトリウム(Purified Sodium Hyaluronate)
分子式
(C14H20NNaO11)n
分子量
平均分子量150万〜390万
構造式
性状
本品は白色の粉末、粒又は繊維状の塊である。
本品は水にやや溶けにくく、エタノール(99.5)にほとんど溶けない。
本品は吸湿性である。
取扱い上の注意
安定性試験の概要
加速試験(25℃、相対湿度60%、6ヵ月)及び長期保存試験(5℃、24ヵ月)の結果、ヒーロン眼粘弾剤1%シリンジ0.4mL、0.6mL及び0.85mLは貯法で定められた条件下において3年間安定であることが推測された。
包装
ヒーロン眼粘弾剤1%シリンジ0.4mL:0.4mL×1筒
ヒーロン眼粘弾剤1%シリンジ0.6mL:0.6mL×1筒
ヒーロン眼粘弾剤1%シリンジ0.85mL:0.85mL×1筒
主要文献及び文献請求先
主要文献
1
武智和男他.基礎と臨床 1985;19:3093-3120.
2
大木孝太郎他.新薬と臨牀 1995;44:19-37.
3
水流忠彦他.新薬と臨牀 1995;44:39-56.
4
深道義尚.眼科臨床医報 1985;79:1380-1395.
5
増田寛次郎他.眼科臨床医報 1985;79:1396-1409.
6
社内資料
7
社内資料
文献請求先
エイエムオー・ジャパン 株式会社
〒105-0001 東京都港区虎ノ門5-13-1
TEL. 03-5402-8920
FAX. 03-5402-8593
製造販売業者等の氏名又は名称及び住所
製造販売元
エイエムオー・ジャパン 株式会社
東京都港区虎ノ門5-13-1
その他の説明(付属機器の取り扱い等)
〔ヒーロン眼粘弾剤1%シリンジの使用法〕
注射筒が落ちないように注意してシールをはがす。
注射筒を取り出す。
●つまんで引き出す方法 ●清潔域に落とす方法
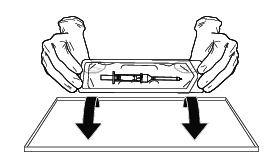
無色ガラス容器(内筒)を完全に押し込み、針でゴム栓を突き破る。
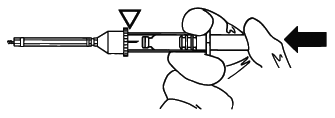
〈注意〉
必ず最初に無色ガラス容器(内筒)の後端を指で押して、最後まで押し込むこと。
プランジャーロッド(押子)を先に使用すると本剤の逆流又は流出のおそれがある。
プランジャーロッド(押子)を外す。
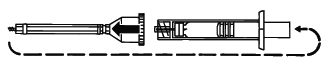
プランジャーロッド(押子)をゴムのプランジャー(押子先端)にねじ込む。
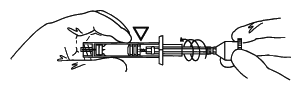
ルアーロック式のカニューレを使用し、しっかり回して固定する。
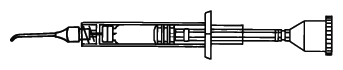 開封後の使用は1回限りとする。
開封後の使用は1回限りとする。<注意>
ブリスター内は無菌包装されています。開封前に破れ、はがれ等があった場合は使用しないでください。