1
臨床薬理試験(ミケランLA点眼液1%・2%:2007年4月18日承認、申請資料概要2.7.6.1)
2
川瀬和秀 他:日本眼科学会雑誌. 2010;114:976-982
3
血漿中カルテオロール濃度の比較(ミケランLA点眼液1%・2%:2007年4月18日承認、申請資料概要2.7.6.3)
4
Kudo S, et al.:Eur J Clin Pharmacol. 1997;52:479-485
5
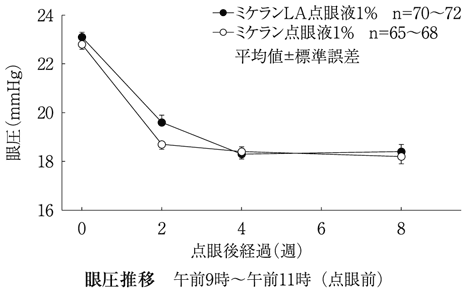
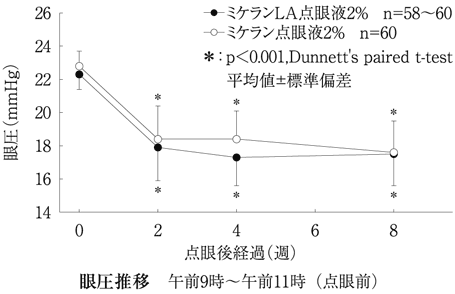
第Ⅲ相比較臨床試験(ミケランLA点眼液1%・2%:2007年4月18日承認、申請資料概要2.7.6.4)
6
全有効性試験の結果の比較検討(ミケランLA点眼液1%・2%:2007年4月18日承認、申請資料概要2.7.3.3)
7
海外第Ⅲ相試験(ミケランLA点眼液1%・2%:2007年4月18日承認、申請資料概要2.7.6.5)
8
海外第Ⅲ相試験(ミケランLA点眼液1%・2%:2007年4月18日承認、申請資料概要2.7.6.6)
9
Yabuuchi Y, et al.:Jpn J Pharmacol. 1974;24:853-861
10
新家 真 他:日本眼科学会雑誌. 1980;84:2085-2091
11
松生俊和 他:眼科臨床医報. 1983;77:1654-1657
12
ウサギにおける眼圧上昇抑制作用(ミケランLA点眼液1%・2%:2007年4月18日承認、申請資料概要2.6.2.2)
13
渡辺耕三 他:応用薬理. 1983;26:1-8
14
梅田和志 他:あたらしい眼科. 2013;30:405-408
15
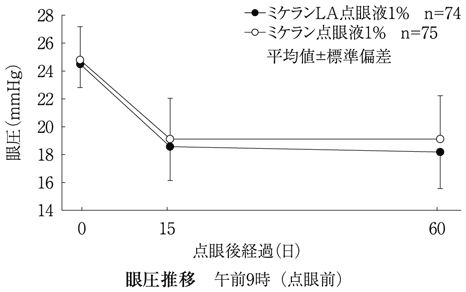
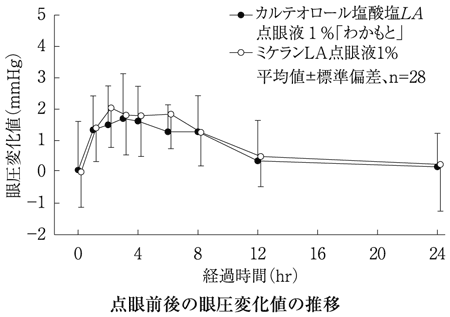
社内資料:生物学的同等性試験(1%製剤)
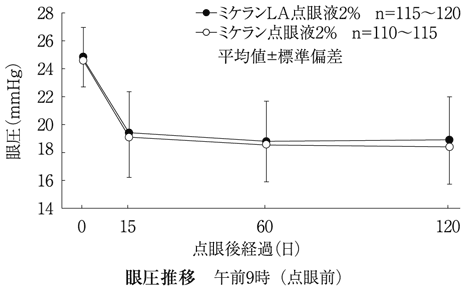
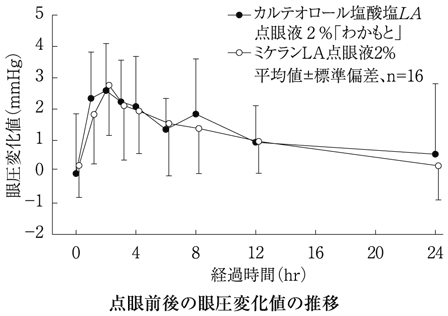
16
社内資料:生物学的同等性試験(2%製剤)