1
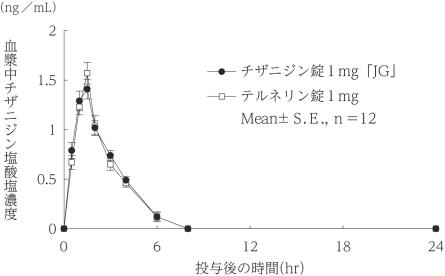
社内資料:生物学的同等性試験
2
山本龍二:診療と新薬.1993;30(1):107-115
3
田中 守:新薬と臨床.1993;42(2):283-288
4
青木虎吉ほか:医学のあゆみ.1986;136(4):311-326
5
中島八十一:Prog. Med.1993;13(2):395-406
6
橋本朋子ほか:臨牀と研究.1993;70(6):1934-1944
7
黒岩義五郎ほか:臨床評価.1986;14(1):43-76
8
第十八改正日本薬局方解説書. 2021:C3238-3242
9
佐藤勝彦ほか:東京医科大学雑誌.1985;43(6):1093-1099
10
小野秀樹ほか:応用薬理.1985;30(5):873-880
11
Ono, H. et al.:Gen. Pharmac.1986;17:137-142
12
Davies, J.:Br. J. Pharmac.1982;76:473-481
13
Davies, J.:Neuropharmacology.1989;28(12):1357-1362