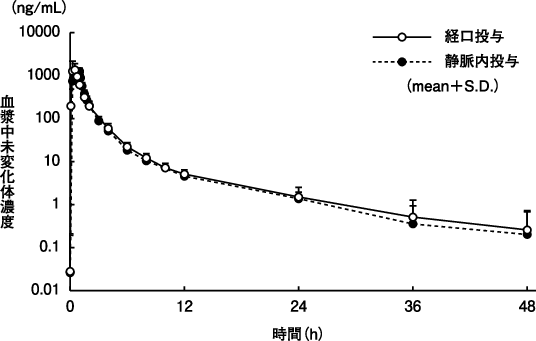
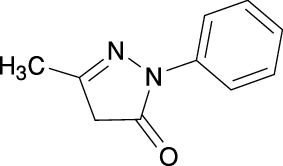
1
Shimizu H, et al.:Clin Pharmacol Drug Dev. 2021 Oct;10(10):1188-1197
2
田辺三菱製薬(株):エダラボンの経口投与における健康成人男性被験者を対象とした第Ⅰ相試験(単回及び反復投与試験)(社内資料)(2022年12月23日承認、CTD2.7.2.2.2.1)
3
田辺三菱製薬(株):エダラボンの経口投与における健康成人男性被験者を対象とした臨床薬理試験(薬物相互作用試験、用法の予備検討試験)(社内資料)(2022年12月23日承認、CTD2.7.2.2.2.2)
4
田辺三菱製薬(株):エダラボンの経口投与における健康成人被験者を対象とした臨床薬理試験(食事の影響検討試験)(社内資料)(2022年12月23日承認、CTD2.7.2.2.2.4)
5
山本美奈子, 他:薬理と治療 1997;25(Suppl.7):1755-1763
6
横田愼一, 他:臨床薬理 1997;28(3):693-702
7
Nakamaru Y, et al.:Clin Ther. 2020 Sep;42(9):1699-1714
8
Nakamaru Y, et al.:Clin Ther. 2020 Aug;42(8):1467-1482.e4
9
田辺三菱製薬(株):長期安全性試験(社内資料)(2022年12月23日承認、CTD2.7.6.12)
10
田辺三菱製薬(株):検証的試験2回目(社内資料)(2015年6月26日承認、CTD2.7.6.1)
11
渡辺俊明, 他:薬理と治療. 1997;25(Suppl.7):1691-1698
12
Yamamoto Y, et al.:Redox Rep. 1996;2(5):333-338
13
Watanabe T, et al.:Prostaglandins Leukot Essent Fatty Acids. 1988;33(1):81-87
14
田辺三菱製薬(株):Effects of MCI-186 in superoxide dismutase(SOD)transgenic rats(amyotrophic lateral sclerosis model)(社内資料)(2015年6月26日承認、CTD2.6.2.2.3)