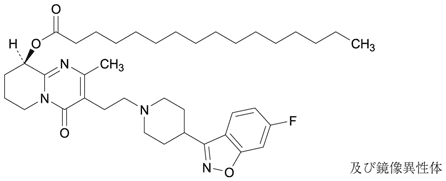
1
Hill RC, et al.:J Clin Psychopharmacol. 2000; 20: 285-286
2
社内資料:パリペリドン徐放錠とカルバマゼピンの相互作用の検討
3
社内資料:リスペリドンのがん原性試験
4
社内資料:リスペリドンのがん原性試験
5
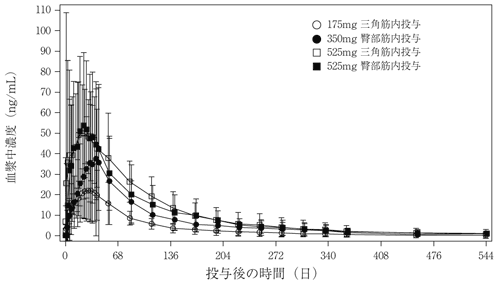
社内資料:パリペリドンパルミチン酸エステル3ヵ月製剤の外国人患者における薬物動態の検討(2020年9月25日承認、CTD2.7.2.2.1)
6
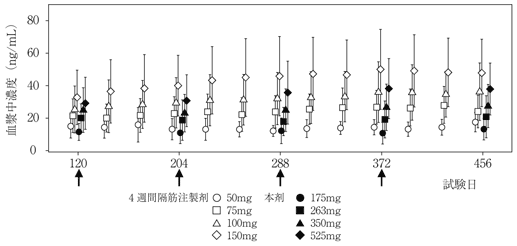
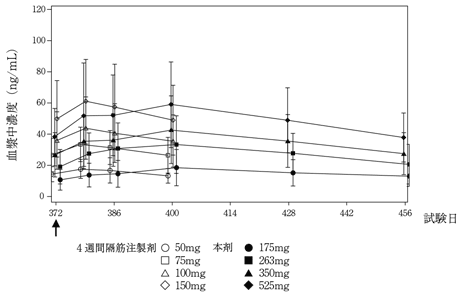
社内資料:パリペリドンパルミチン酸エステル3ヵ月製剤の国際共同試験成績(2020年9月25日承認、CTD2.7.2.2.3)
7
社内資料:パリペリドンの蛋白結合率の検討
8
社内資料:パリペリドンパルミチン酸エステルの代謝の検討
9
社内資料:パリペリドンの代謝の検討
10
社内資料:パリペリドンの代謝酵素の検討
11
社内資料:パリペリドンの代謝及び排泄の検討
12
社内資料:パリペリドンパルミチン酸エステル3ヵ月製剤の母集団薬物動態解析(2020年9月25日承認、CTD2.7.2.3.2)
13
社内資料:腎機能障害被験者におけるパリペリドン徐放錠の薬物動態の検討
14
Boom S, et al.:Int J Clin Pharmacol Ther. 2009; 47: 606-616
15
社内資料:高齢者におけるパリペリドン徐放錠の薬物動態の検討
16
社内資料:パリペリドン徐放錠とパロキセチンの相互作用の検討
17
社内資料:パリペリドン徐放錠とトリメトプリムの相互作用の検討
18
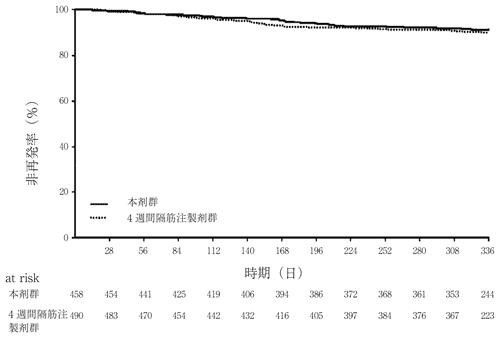
社内資料:パリペリドンパルミチン酸エステル3ヵ月製剤の国際共同試験成績(2020年9月25日承認、CTD2.7.6.3.1)
19
社内資料:パリペリドンの抗ドパミン作用及び抗セロトニン作用
20
社内資料:パリペリドンの抗ドパミン作用及びカタレプシー惹起作用
21
社内資料:パリペリドンの抗セロトニン作用
22
Megens AAHP, et al.:Drug development research. 1994; 33: 399-412
23
Leysen JE, et al.:J Clin Psychiatry. 1994; 55(suppl. 5) : 5-12