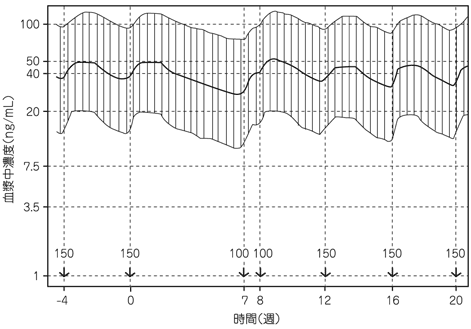
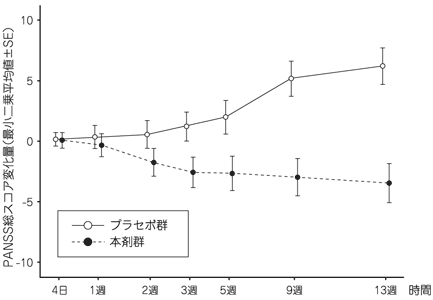
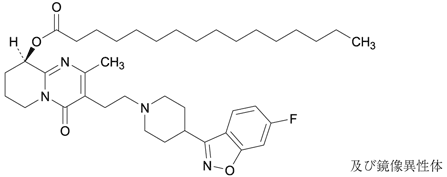
1
Hill RC, et al.:J Clin Psychopharmacol. 2000; 20: 285-286
2
社内資料:パリペリドン徐放錠とカルバマゼピンの相互作用の検討
3
社内資料:リスペリドンのがん原性試験
4
社内資料:リスペリドンのがん原性試験
5
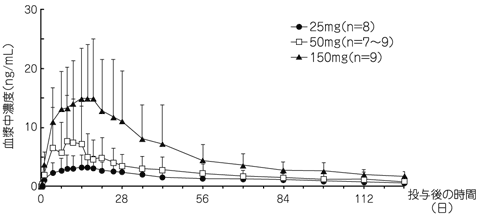
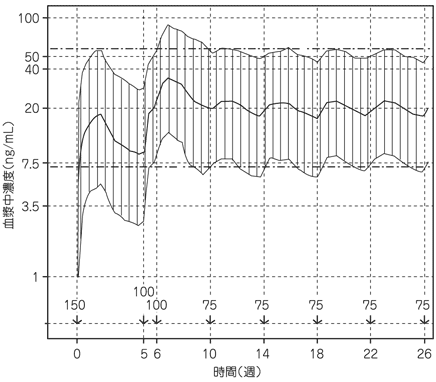
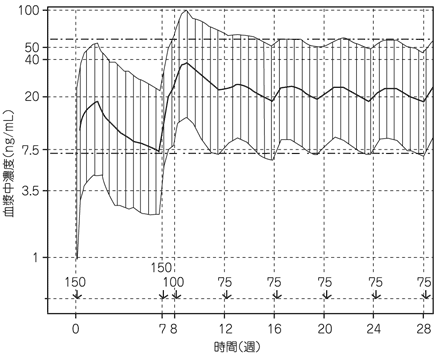
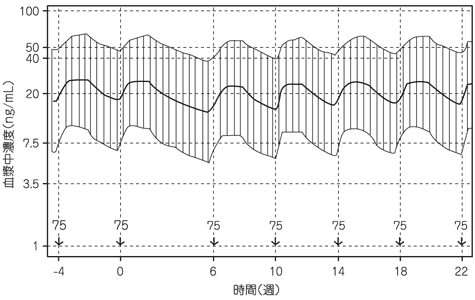
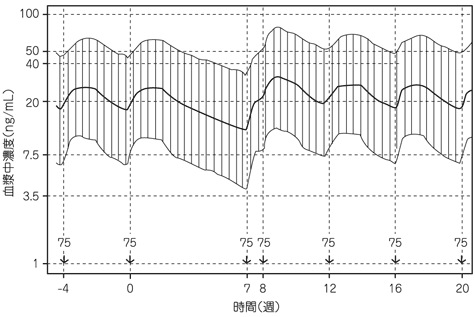
社内資料:パリペリドンパルミチン酸エステルの薬物動態の検討(2013年9月20日承認、CTD 2.7.2.2.2, 2.7.2.3.1.1)
6
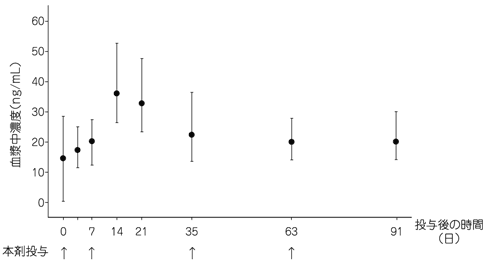
社内資料:パリペリドンパルミチン酸エステルの外国人における薬物動態の検討(2013年9月20日承認、CTD 2.7.2.2.3, 2.7.2.3.1.1)
7
社内資料:パリペリドンパルミチン酸エステルの薬物動態の検討(2013年9月20日承認、CTD 2.7.2.2.2, 2.7.2.3.2)
8
社内資料:パリペリドンの蛋白結合率の検討
9
社内資料:パリペリドンパルミチン酸エステルの代謝の検討
10
社内資料:パリペリドンの代謝の検討(2013年9月20日承認、CTD 2.6.4.9.3)
11
社内資料:パリペリドンの代謝酵素の検討
12
社内資料:パリペリドンの代謝及び排泄の検討(2013年9月20日承認、CTD 2.7.2.3.1.3)
13
社内資料:腎機能障害被験者におけるパリペリドン徐放錠の薬物動態の検討
14
Boom S, et al.:Int J Clin Pharmacol Ther. 2009; 47: 606-616
15
社内資料:高齢者におけるパリペリドン徐放錠の薬物動態の検討
16
社内資料:パリペリドン徐放錠とパロキセチンの相互作用の検討
17
社内資料:パリペリドン徐放錠とトリメトプリムの相互作用の検討
18
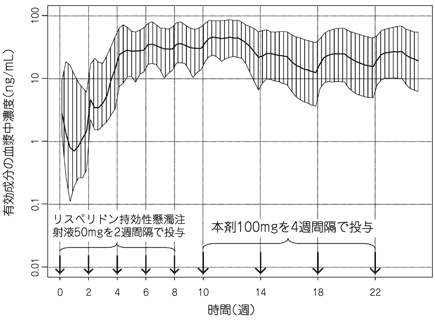
社内資料:パリペリドンパルミチン酸エステルの国際共同試験成績(2013年9月20日承認、CTD 2.7.6.13)
19
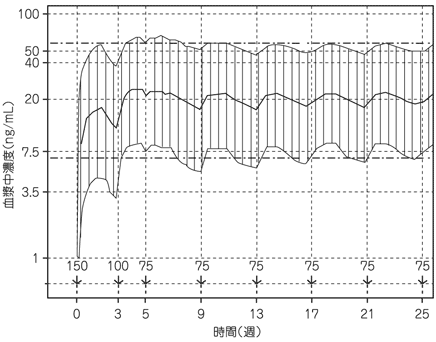
社内資料:パリペリドンパルミチン酸エステルの国内長期投与試験成績(2013年9月20日承認、CTD 2.7.6.4.24)
20
社内資料:パリペリドンの抗ドパミン作用及び抗セロトニン作用
21
社内資料:パリペリドンの抗ドパミン作用及びカタレプシー惹起作用
22
社内資料:パリペリドンの抗セロトニン作用
23
Megens AAHP, et al.:Drug development research. 1994; 33: 399-412
24
Leysen JE, et al.:J Clin Psychiatry. 1994; 55(suppl. 5): 5-12