1
Hill RC, et al.:J Clin Psychopharmacol. 2000; 20: 285-286
2
Saito M, et al.:J Clin Psychopharmacol. 2005; 25: 527-532
3
Spina E, et al.:Ther Drug Monit. 2000; 22: 481-485
4
Mahatthanatrakul W, et al.:J Clin Pharm Ther. 2007; 32: 161-167
5
Jung SM, et al.:Clin Pharmacol Ther. 2005; 78: 520-528
6
社内資料:リスパダールコンスタのがん原性試験(2009年4月22日承認、CTD 2.6.6.5.(2).1))
7
社内資料:リスパダールコンスタの単回投与時の薬物動態の検討(2009年4月22日承認、CTD 2.7.6.5)
8
社内資料:リスパダールコンスタの反復投与時の薬物動態の検討(2009年4月22日承認、CTD 2.7.6.4)
9
社内資料:リスパダールコンスタの体組織への分布の検討(2009年4月22日承認、CTD 2.6.4.4.(1).2))
10
Nyberg S, et al.:Psychopharmacol. 1993; 110: 265-272
11
Mannens G, et al.:Psychopharmacol. 1994; 114: 566-572
12
Mannens G, et al.:Drug Metab Dispos. 1993; 21: 1134-1141
13
Schotte A, et al.:Jpn J Pharmacol. 1995; 69: 399-412
14
社内資料:リスペリドンの代謝物の活性の検討
15
石郷岡純, 他:臨床評価. 1991; 19: 93-163
16
Snoeck E, et al.:Psychopharmacol. 1995; 122: 223-229
17
社内資料:経口リスペリドン製剤とカルバマゼピンとの相互作用の検討
18
社内資料:経口リスペリドン製剤とシメチジン及びラニチジンとの相互作用の検討
19
Spina E, et al.:Ther Drug Monit. 2004; 26: 386-390
20
D’Arrigo C, et al.:Pharmacol Res. 2005; 52: 497-501
21
Nakagami T, et al.:Clin Pharmacol Ther. 2005; 78: 43-51
22
社内資料:経口リスペリドン製剤とアミトリプチリンとの相互作用の検討
23
社内資料:経口リスペリドン製剤とエリスロマイシンとの相互作用の検討
24
社内資料:経口リスペリドン製剤とトピラマートとの相互作用の検討
25
社内資料:経口リスペリドン製剤とガランタミンとの相互作用の検討
26
社内資料:経口リスペリドン製剤とドネペジルとの相互作用の検討
27
社内資料:経口リスペリドン製剤とジゴキシンとの相互作用の検討
28
社内資料:経口リスペリドン製剤とバルプロ酸との相互作用の検討
29
社内資料:経口リスペリドン製剤とリチウムとの相互作用の検討
30
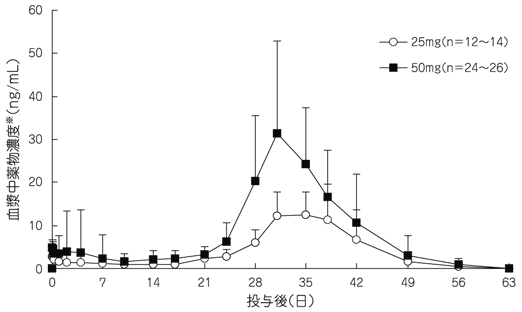
社内資料:リスパダールコンスタの国内第Ⅲ相臨床試験成績(2009年4月22日承認、CTD 2.7.6.7)
31
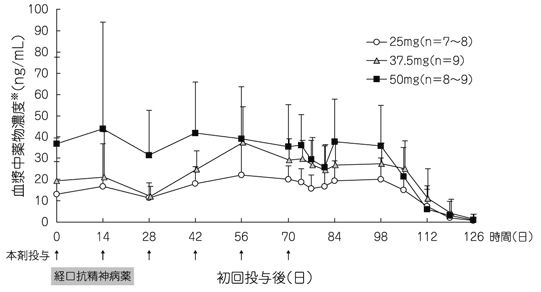
社内資料:リスパダールコンスタの外国第Ⅲ相臨床試験成績(2009年4月22日承認、CTD 2.7.6.8)
32
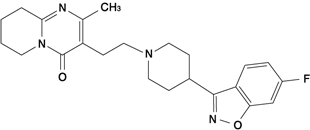
Janssen PAJ, et al.:J Pharmacol Exp Ther. 1988; 244: 685-693
33
Leysen JE, et al.:Mol Pharmacol. 1992; 41: 494-508
34
Megens A, et al.:J Pharmacol Exp Ther. 1992; 260: 146-159
35
菊本修, 他:薬物・精神・行動. 1993; 13: 39-42