1
背景及び概観(ストラテラカプセル:2012.8.24承認、CTD2.7.2.1)
2
日本人健康成人を対象としたアトモキセチン単回投与及び反復投与試験(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
3
健康成人と患児の薬物動態の比較(ストラテラカプセル:2009.4.22承認、CTD2.7.2.3.1.1.3)
4
小児注意欠陥/多動性障害(AD/HD)患児を対象とした安全性及び薬物動態試験(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
5
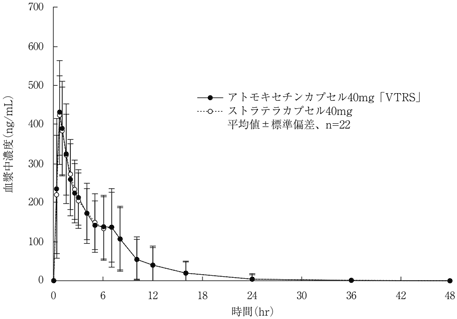
社内資料:生物学的同等性試験(アトモキセチンカプセル40mg「VTRS」)
6
相対的及び絶対的バイオアベイラビリティ(ストラテラカプセル:2009.4.22承認、CTD2.7.1.3.1)
7
バイオアベイラビリティに対する食事の影響(ストラテラカプセル:2009.4.22承認、CTD2.7.1.3.3)
8
分布(ストラテラカプセル:2009.4.22承認、CTD2.7.2.3.1.2)
9
代謝(ストラテラカプセル:2009.4.22承認、CTD2.7.2.3.1.3)
10
Sauer JM,et al.:Drug Metab Dispos. 2003;31(1):98-107
11
ヒト生体試料を用いたin vitro試験(ストラテラカプセル:2009.4.22承認、CTD2.7.2.2.1)
12
外国人健康成人を対象とした併合解析の方法(ストラテラカプセル:2009.4.22承認、CTD2.7.2.5.1.2)
13
CYP2D6分類の変更に伴うLYAN試験の再解析(ストラテラカプセル:2012.8.24承認、CTD2.7.2.2.2.1)
14
外国人PM健康成人における薬物動態(ストラテラカプセル:2009.4.22承認、CTD2.7.2.3.1.1.1.2.2)
15
健康成人における薬物動態及び忍容性試験(ストラテラカプセル:2009.4.22承認、CTD2.7.2.2.2)
16
薬物動態に関する内因性因子の検討(ストラテラカプセル:2009.4.22承認、CTD2.7.2.2.4)
17
個々の試験の薬物動態パラメータ(ストラテラカプセル:2009.4.22承認、CTD2.7.2.5.1.1)
18
経口メチルフェニデート存在下においてアトモキセチンを反復投与したときの血行力学パラメータに及ぼす影響の検討(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
19
アトモキセチン併用時におけるサルブタモール吸入投与後の血行力学パラメータの変化についての検討(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
20
アトモキセチン反復投与時におけるサルブタモール単回静脈内投与後の血行力学パラメータの変化についての検討(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
21
健康成人を対象としたアトモキセチン及びパロキセチン併用時における安全性及び薬物動態学的相互作用の検討(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
22
健康成人を対象としたアトモキセチン及びフルオキセチン併用時における安全性及び薬物動態学的相互作用の検討(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
23
絶対的バイオアベイラビリティ並びにマーロックス及びオメプラゾール投与時の相対的バイオアベイラビリティについての検討(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
24
CYP2D6PM健康成人を対象としたアトモキセチン及びミダゾラム併用時における安全性及び薬物動態学的相互作用の検討(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
25
CYP2D6EM及びPM健康成人を対象としたアトモキセチン及びエタノール併用時における精神運動作用についての検討(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
26
社内資料:溶出試験(アトモキセチンカプセル5mg「VTRS」)
27
社内資料:溶出試験(アトモキセチンカプセル10mg「VTRS」)
28
社内資料:溶出試験(アトモキセチンカプセル25mg「VTRS」)
29
Takahashi M,et al.:J Child Adolesc Psychopharmacol. 2009;19(4):341-51
30
LYBC試験(プラセボ対照二重盲検比較試験)(ストラテラカプセル:2009.4.22承認、CTD2.7.3.1)
31
小児AD/HD患者に対する第Ⅲ相長期継続投与臨床試験(ストラテラカプセル:2009.4.22承認、CTD2.7.6.2)
32
Michelson D,et al.:Pediatrics. 2001;108(5):e83
33
成人AD/HD患者に対する第Ⅲ相短期投与プラセボ対照二重盲検比較試験(ストラテラカプセル:2012.8.24承認、CTD2.5.4.2.3)
34
LYEE試験:プラセボ対照二重盲検比較試験(ストラテラカプセル:2009.4.22承認、CTD2.7.4.1)
35
B4Z-JE-LYEE試験(ストラテラカプセル:2012.8.24承認、CTD2.7.6.3)
36
成人AD/HD患者に対する第Ⅲ相長期継続投与臨床試験(ストラテラカプセル:2012.8.24承認、CTD2.5.4.2.4)
37
B4Z-JE-LYEK試験(ストラテラカプセル:2012.8.24承認、CTD2.7.6.4)
38
B4Z-EW-LYDX試験(ストラテラカプセル:2012.8.24承認、CTD2.7.6.2.1)
39
緒言(ストラテラカプセル:2009.4.22承認、CTD2.2)
40
モノアミン取り込み阻害作用の検討(ストラテラカプセル:2009.4.22承認、CTD2.6.2.2.1.2)
41
受容体結合(ストラテラカプセル:2009.4.22承認、CTD2.6.2.3.1)
42
Bymaster FP,et al.:Neuropsychopharmacology. 2002;27(5):699-711