1
単回投与(空腹時投与)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.2.2)
2
単回投与(食後投与)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.6.9)
3
反復投与(食後投与)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.2.2)
4
田中孝典他:診療と新薬, 2019;56(4):282-293
5
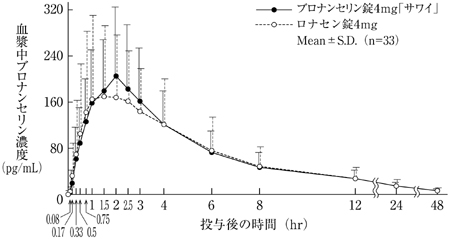
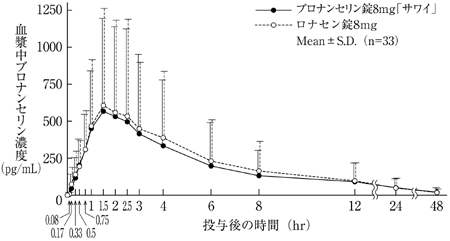
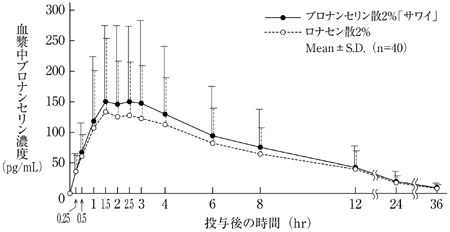
社内資料:生物学的同等性試験(散2%)
6
吸収(ロナセン錠/散:2008年1月25日承認、申請資料概要2.6.4.3)
7
血清蛋白結合率(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.2.2)
8
N-脱エチル体の薬理作用(in vivo試験)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.6.2.2)
9
ヒトの血漿、尿および糞中の代謝物検索(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.2.2)
10
代謝(ロナセン錠/散:2008年1月25日承認、申請資料概要2.6.4.5)
11
ヒト代謝CYPの同定(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.2.2)
12
14C標識体を用いたマスバランス試験(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.2.2)
13
松本和也他:臨床精神薬理, 2008;11:891-899
14
エリスロマイシン併用時の薬物動態(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.2.2)
15
松本和也他:臨床精神薬理, 2008;11:901-909
16
グレープフルーツジュース併用時の薬物動態(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.2.2)
17
ケトコナゾールとの薬物相互作用試験(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.6.13, 2.7.2.2)
18
社内資料:生物学的同等性試験(錠2mg)
19
三浦貞則:臨床精神薬理, 2008;11:297-314
20
村崎光邦:臨床精神薬理, 2007;10:2059-2079
21
第III相試験(ハロペリドール)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.6.15)
22
長期投与試験(1)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.6.20)
23
村崎光邦:臨床精神薬理, 2007;10:2241-2257
24
長期投与試験(2)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.6.21)
25
長期投与試験(2)(3)(ロナセン錠/散:2008年1月25日承認、審査報告書)
26
木下利彦:臨床精神薬理, 2008;11:135-153
27
長期投与試験(3)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.7.6.22)
28
釆輝昭他:臨床精神薬理, 2007;10:1263-1272
29
ドパミンD2、D3及びセロトニン5-HT2A受容体に対する作動作用及び拮抗作用(ロナセンテープ:2019年6月18日承認、申請資料概要2.6.2.2)
30
ムスカリンM3受容体への結合親和性(ロナセンテープ:2019年6月18日承認、申請資料概要2.6.2.2)
31
N-脱エチル体の薬理作用(in vitro試験)(ロナセン錠/散:2008年1月25日承認、申請資料概要2.6.2.2)
32
Noda, Y. et al.:J. Pharmacol. Exp. Ther., 1993;265:745-751
33
メタンフェタミン誘発運動過多に対する抑制作用(ロナセン錠/散:2008年1月25日承認、申請資料概要2.6.2.2)