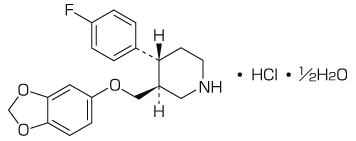
選択的セロトニン再取り込み阻害剤
1錠 18.3円
 5.6
5.6 約66
約66 2.5
2.5 6.6
6.6 約130
約130 3.7
3.7 8.1
8.1 約260
約260 4.7
4.7| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| MAO阻害剤 セレギリン塩酸塩 (エフピー) **ラサギリンメシル酸塩 (アジレクト) **サフィナミドメシル酸塩 (エクフィナ) | セロトニン症候群があらわれることがある。MAO阻害剤を投与中あるいは投与中止後2週間以内の患者には投与しないこと。また、本剤の投与中止後2週間以内にMAO阻害剤の投与を開始しないこと。(「重大な副作用」の項参照) | 脳内セロトニン濃度が高まると考えられている。 |
| **ピモジド | **QT延長、心室性不整脈(torsade de pointesを含む)等の重篤な心臓血管系の副作用があらわれるおそれがある。 | ピモジド(2mg)とパロキセチン塩酸塩との併用により、ピモジドの血中濃度が上昇したことが報告されている。本剤が肝臓の薬物代謝酵素CYP2D6を阻害することによると考えられる。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| セロトニン作用を有する薬剤 炭酸リチウム 選択的セロトニン再取り込み阻害剤 トリプタン系薬剤(スマトリプタン等) セロトニン前駆物質(L-トリプトファン、5-ヒドロキシトリプトファン等)含有製剤又は食品等 トラマドール フェンタニル リネゾリド セイヨウオトギリソウ(St. John's Wort;セント・ジョーンズ・ワート)含有食品等 | セロトニン症候群等のセロトニン作用による症状があらわれることがある。 これらの薬物を併用する際には観察を十分に行うこと。(「重大な副作用」の項参照) | 相互にセロトニン作用が増強するおそれがある。 |
| メチルチオニニウム塩化物水和物(メチレンブルー) | セロトニン症候群等のセロトニン作用による症状があらわれることがある。 これらの薬物を併用する際には観察を十分に行うこと。(「重大な副作用」の項参照) | メチルチオニニウム塩化物水和物はMAO阻害作用を有するため、セロトニン作用が増強される。 |
| フェノチアジン系抗精神病剤 ペルフェナジン リスペリドン | これらの抗精神病剤との併用により悪性症候群があらわれるおそれがある。(「重大な副作用」の項参照) これらの薬剤の作用が増強され、過鎮静、錐体外路症状等の発現が報告されている。 | 本剤が肝臓の薬物代謝酵素CYP2D6を阻害することにより、患者によってはこれら薬剤の血中濃度が上昇するおそれがある。 パロキセチン塩酸塩とペルフェナジンとの併用により、ペルフェナジンの血中濃度が約6倍増加したことが報告されている。 パロキセチン塩酸塩とリスペリドンとの併用により、リスペリドン及び活性代謝物の血中濃度が約1.4倍増加したことが報告されている。 パロキセチン塩酸塩とイミプラミンとの併用により、イミプラミンのAUCが約1.7倍増加したことが報告されている。 |
| 三環系抗うつ剤 アミトリプチリン塩酸塩 ノルトリプチリン塩酸塩 イミプラミン塩酸塩 | これら薬剤の作用が増強されるおそれがある。イミプラミンと本剤の薬物相互作用試験において、併用投与により鎮静及び抗コリン作用の症状が報告されている。 | 本剤が肝臓の薬物代謝酵素CYP2D6を阻害することにより、患者によってはこれら薬剤の血中濃度が上昇するおそれがある。 パロキセチン塩酸塩とペルフェナジンとの併用により、ペルフェナジンの血中濃度が約6倍増加したことが報告されている。 パロキセチン塩酸塩とリスペリドンとの併用により、リスペリドン及び活性代謝物の血中濃度が約1.4倍増加したことが報告されている。 パロキセチン塩酸塩とイミプラミンとの併用により、イミプラミンのAUCが約1.7倍増加したことが報告されている。 |
| 抗不整脈剤 プロパフェノン塩酸塩 フレカイニド酢酸塩 | これら薬剤の作用が増強されるおそれがある。 | 本剤が肝臓の薬物代謝酵素CYP2D6を阻害することにより、患者によってはこれら薬剤の血中濃度が上昇するおそれがある。 パロキセチン塩酸塩とペルフェナジンとの併用により、ペルフェナジンの血中濃度が約6倍増加したことが報告されている。 パロキセチン塩酸塩とリスペリドンとの併用により、リスペリドン及び活性代謝物の血中濃度が約1.4倍増加したことが報告されている。 パロキセチン塩酸塩とイミプラミンとの併用により、イミプラミンのAUCが約1.7倍増加したことが報告されている。 |
| β-遮断剤 チモロールマレイン酸塩 | これら薬剤の作用が増強されるおそれがある。 | 本剤が肝臓の薬物代謝酵素CYP2D6を阻害することにより、患者によってはこれら薬剤の血中濃度が上昇するおそれがある。 パロキセチン塩酸塩とペルフェナジンとの併用により、ペルフェナジンの血中濃度が約6倍増加したことが報告されている。 パロキセチン塩酸塩とリスペリドンとの併用により、リスペリドン及び活性代謝物の血中濃度が約1.4倍増加したことが報告されている。 パロキセチン塩酸塩とイミプラミンとの併用により、イミプラミンのAUCが約1.7倍増加したことが報告されている。 |
| β-遮断剤 メトプロロール酒石酸塩 | メトプロロールとパロキセチン塩酸塩の併用投与により、重度の血圧低下が報告されている。 | パロキセチン塩酸塩が肝臓の薬物代謝酵素CYP2D6を阻害することにより、メトプロロールの(S)-体及び(R)-体のT1/2がそれぞれ約2.1及び2.5倍、AUCがそれぞれ約5及び8倍増加したことが報告されている。 |
| アトモキセチン | 併用によりアトモキセチンの血中濃度が上昇したとの報告がある。 | 本剤が肝臓の薬物代謝酵素CYP2D6を阻害することによると考えられる。 |
| タモキシフェン | タモキシフェンの作用が減弱されるおそれがある。 併用により乳癌による死亡リスクが増加したとの報告がある。 | 本剤が肝臓の薬物代謝酵素CYP2D6を阻害することにより、タモキシフェンの活性代謝物の血中濃度が減少するおそれがある。 |
| キニジン シメチジン | 本剤の作用が増強するおそれがある。 | これらの薬剤の肝薬物代謝酵素阻害作用により、本剤の血中濃度が上昇するおそれがある。シメチジンとの併用により、パロキセチン塩酸塩の血中濃度が約50%増加したことが報告されている。 |
| フェニトイン フェノバルビタール カルバマゼピン リファンピシン | 本剤の作用が減弱するおそれがある。 | これらの薬剤の肝薬物代謝酵素誘導作用により、本剤の血中濃度が低下するおそれがある。フェノバルビタールとの併用により、パロキセチン塩酸塩のAUC及びT1/2がそれぞれ平均25及び38%減少したことが報告されている。 |
| ホスアンプレナビルとリトナビルの併用時 | 本剤の作用が減弱するおそれがある。 | 作用機序は不明であるが、ホスアンプレナビルとリトナビルとの併用時にパロキセチン塩酸塩の血中濃度が約60%減少したことが報告されている。 |
| ワルファリン | ワルファリンの作用が増強されるおそれがある。 | パロキセチン塩酸塩との相互作用は認められていないが、他の抗うつ剤で作用の増強が報告されている。 |
| ジゴキシン | ジゴキシンの作用が減弱されるおそれがある。 | 健康人において、パロキセチン塩酸塩によるジゴキシンの血中濃度の低下が認められている。 |
| 止血・血液凝固を阻害する薬剤 非ステロイド性抗炎症剤 アスピリン ワルファリン等 出血症状の報告のある薬剤 フェノチアジン系抗精神病剤 非定型抗精神病剤 三環系抗うつ剤等 | 出血傾向が増強するおそれがある。 | これらの薬剤を併用することにより作用が増強されることが考えられる。 |
| アルコール(飲酒) | 本剤服用中は、飲酒を避けることが望ましい。 | 本剤との相互作用は認められていないが、他の抗うつ剤で作用の増強が報告されている。 |
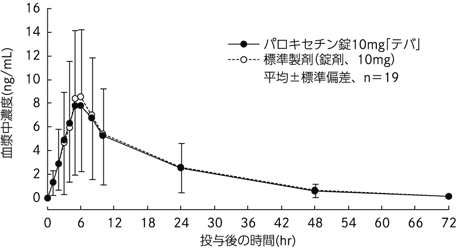
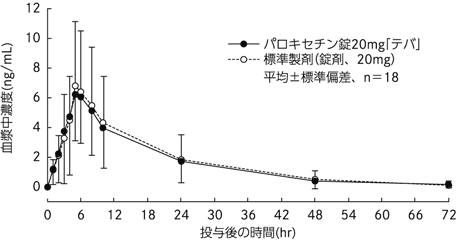
| 投与量 (mg) | AUC0-72 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
| パロキセチン錠10mg「テバ」 | 20 | 154.57±119.63 | 8.30±5.87 | 5.2±1.3 | 11.6±1.5 |
| 標準製剤(錠剤、10mg) | 20 | 161.00±118.09 | 8.91±5.93 | 5.2±1.2 | 11.5±1.5 |
| 投与量 (mg) | AUC0-72 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
| パロキセチン錠20mg「テバ」 | 20 | 113.36±78.62 | 6.62±3.19 | 5.3±1.3 | 12.0±3.6 |
| 標準製剤(錠剤、20mg) | 20 | 120.04±93.32 | 7.20±4.54 | 5.4±1.1 | 11.3±1.9 |