1
社内資料:生物学的同等性試験(ゾテピン細粒10%「タカタ」)
2
社内資料:生物学的同等性試験(ゾテピン細粒50%「タカタ」)
3
社内資料:生物学的同等性試験(ゾテピン錠25mg「タカタ」)
4
社内資料:生物学的同等性試験(ゾテピン錠50mg「タカタ」)
5
坂本宏 他:北陸神経精神医学雑誌 1996:10(1-2):65
6
社内資料:生物学的同等性試験及び溶出性試験(ゾテピン錠100mg「タカタ」)
7
黒木俊秀: Pharma Medica 1999:17(8): 131-136
統合失調症治療剤
1錠 9.6円
有効成分 | 1g中 ゾテピン 100mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、含水二酸化ケイ素 |
有効成分 | 1g中 ゾテピン 500mg |
|---|---|
添加剤 | 乳糖水和物、デキストリン、トウモロコシデンプン、含水二酸化ケイ素 |
有効成分 | 1錠中 ゾテピン 25mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、結晶セルロース、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、酸化チタン、黄色三二酸化鉄、カルナウバロウ |
有効成分 | 1錠中 ゾテピン 50mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、結晶セルロース、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、酸化チタン、黄色三二酸化鉄、カルナウバロウ |
有効成分 | 1錠中 ゾテピン 100mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、結晶セルロース、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール6000、酸化チタン、黄色三二酸化鉄、カルナウバロウ |
| 性状 | 白色の細粒で、においはない。 |
|---|
| 性状 | 白色の細粒で、においはない。 |
|---|
| 性状 | 淡黄色のフィルムコーティング錠で、においはない。 |
|---|---|
| 外形 | 表面 直径  約5.2mm 裏面 重さ  約0.06g 側面 厚さ  約2.6mm |
| 識別コード | TTS-190 |
| 性状 | 淡黄色のフィルムコーティング錠で、においはない。 |
|---|---|
| 外形 | 表面 直径  約6.7mm 裏面 重さ  約0.11g 側面 厚さ  約3.2mm |
| 識別コード | TTS-191 |
| 性状 | 淡黄色のフィルムコーティング錠で、においはない。 |
|---|---|
| 外形 | 表面 直径  約8.7mm 裏面 重さ  約0.22g 側面 厚さ  約3.5mm |
| 識別コード | TTS-192 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
アドレナリン (アナフィラキシーの救急治療、又は歯科領域における浸潤麻酔もしくは伝達麻酔に使用する場合を除く) (ボスミン) | アドレナリンの作用を逆転させ、重篤な血圧低下を起こすおそれがある。 | アドレナリンはα、β受容体の刺激剤であり、本剤のα受容体遮断作用により、β受容体刺激作用が優位となり、血圧低下作用が増強される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
中枢神経抑制剤 バルビツール酸誘導体 麻酔剤等 | 相互に中枢神経抑制作用を増強させることがある。 | 本剤及びこれらの薬剤は中枢神経抑制作用を有する。 |
降圧剤 | 相互に降圧作用を増強させることがある。 | 本剤及びこれらの薬剤は降圧作用を有する。 |
抗コリン作用を有する薬剤 抗コリン性抗パーキンソン剤 三環系抗うつ剤等 | 相互に抗コリン作用を増強させることがある。 | 本剤及びこれらの薬剤は抗コリン作用を有する。 |
メトクロプラミド ドンペリドン | 内分泌機能異常、錐体外路症状が発現しやすくなる。 | 本剤及びこれらの薬剤は抗ドパミン作用を有するため、併用により抗ドパミン作用が強くあらわれる。 |
ドパミン作動薬 レボドパ等 | 相互に作用を減弱させることがある。 | 本剤は抗ドパミン作用を有するため、作用が拮抗する。 |
アルコール 飲酒 | 相互に中枢神経抑制作用を増強させることがある。 | ともに中枢神経抑制作用を有する。 |
有機燐殺虫剤 | 相互に作用し、有機燐殺虫剤の毒性を増強させるおそれがあるので、接触しないように注意すること。 | 有機燐殺虫剤の抗コリンエステラーゼ作用を増強し、その毒性を強めるおそれがある。 |
アドレナリン含有歯科麻酔剤 リドカイン・アドレナリン | 重篤な血圧低下を起こすおそれがある。 | アドレナリンはα、β受容体の刺激剤であり、本剤のα受容体遮断作用により、β受容体刺激作用が優位となり、血圧低下作用が増強されるおそれがある。 |
5%以上 | 0.1~5%未満 | 0.1%未満 | |
|---|---|---|---|
循環器 | 血圧降下、頻脈 | 不整脈、息苦しさ | |
消化器 | 便秘、悪心・嘔吐、食欲不振、腹部不快感 | 下痢、口内炎、食欲亢進、腹部膨満感 | |
肝臓 | 肝障害 | ||
錐体外路症状 | パーキンソン症候群(手指振戦、流涎、筋強剛、運動減少、歩行障害、膏顔、仮面様顔貌等) | ジスキネジア(構音障害、眼球回転発作、嚥下障害、姿勢異常等)、アカシジア(静坐不能) | |
精神神経系 | 眠気、脳波異常 | 不眠、不安・焦燥、不穏・興奮、易刺激、意識障害 | 性欲亢進 |
過敏症 | 発疹 | 皮膚そう痒感 | |
自律神経系 | 脱力・倦怠感、口渇、めまい、頭痛・頭重、鼻閉、排尿困難、しびれ感、失禁 | 発汗、頻尿 | |
内分泌 | 月経異常、乳汁分泌 | ||
その他 | 血清尿酸低下 | 視覚障害、浮腫 | 発熱、味覚異常、体重増加、体重減少、瞳孔散大 |

判定パラメータ | 参考パラメータ | |||
AUCt (ng・hr/mL) | Cmax (ng/mL) | tmax (hr) | t1/2 (hr) | |
ゾテピン細粒10%「タカタ」 | 153.71±21.47 | 17.20±5.16 | 1.9±0.2 | 15.3±2.3 |
ロドピン細粒10% | 148.18±16.67 | 15.23±2.44 | 2.1±0.2 | 18.5±3.8 |

判定パラメータ | 参考パラメータ | |||
AUCt (ng・hr/mL) | Cmax (ng/mL) | tmax (hr) | t1/2 (hr) | |
ゾテピン細粒50%「タカタ」 | 58.37±33.00 | 5.89±3.63 | 1.7±0.4 | 19.3±5.7 |
ロドピン細粒50% | 55.21±36.77 | 5.91±4.92 | 1.9±0.5 | 18.4±5.3 |

判定パラメータ | 参考パラメータ | |||
AUCt (ng・hr/mL) | Cmax (ng/mL) | tmax (hr) | t1/2 (hr) | |
ゾテピン錠25mg「タカタ」 | 65.53±13.12 | 6.10±1.37 | 4.1±0.5 | 17.6±3.6 |
ロドピン錠25mg | 62.71±12.38 | 6.44±1.45 | 4.1±0.6 | 19.4±7.4 |
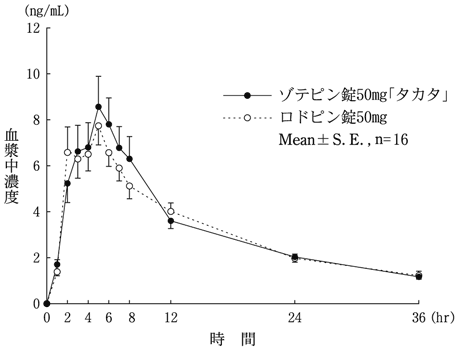
判定パラメータ | 参考パラメータ | |||
AUCt (ng・hr/mL) | Cmax (ng/mL) | tmax (hr) | t1/2 (hr) | |
ゾテピン錠50mg「タカタ」 | 119.48±26.26 | 9.76±2.77 | 5.0±0.3 | 16.8±2.0 |
ロドピン錠50mg | 117.25±22.59 | 9.41±2.20 | 4.4±0.4 | 15.9±1.5 |