1
社内資料:日本人単回貼付試験(2011年2月23日承認、CTD2.7.6.2.1.1)
2
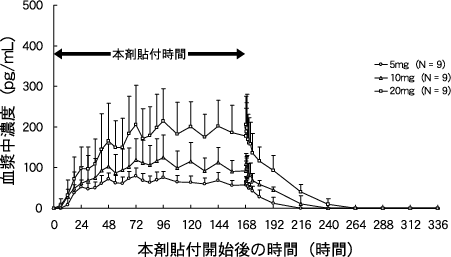
社内資料:日本人反復貼付試験(2011年2月23日承認、CTD2.7.6.4.2)
3
社内資料:外国人高齢者における薬物動態(単回貼付)(2011年2月23日承認、CTD2.7.6.2.3.1)
4
社内資料:外国人高齢者における薬物動態(反復貼付)(2011年2月23日承認、CTD2.7.6.2.3.2)
5
社内資料:肝機能障害患者における薬物動態(2011年2月23日承認、CTD2.7.6.2.3.3)
6
Hand C.W., et al.:Br J Anaesth, 1990;64(3), 276-282
7
社内資料:血中濃度に及ぼす局所加温の影響(2011年2月23日承認、CTD2.7.6.2.4.2)
8
社内資料:絶対的バイオアベイラビリティの検討(2011年2月23日承認、CTD2.7.6.1.1.1)
9
社内資料:血漿蛋白結合(2011年2月23日承認、CTD2.6.4.4.2)
10
社内資料:マウスにおける組織分布(2011年2月23日承認、CTD4.2.2.3.1)
11
Nanovskaya T, et al.:J Pharmacol Exp Ther, 2002;300(1), 26-33
12
Marquet P, et al.:Clin Pharmacol Ther, 1997;62(5), 569-571
13
Iribarne C, et al.:Life Sci, 1997;60(22), 1953-1964
14
Kobayashi K, et al.:Drug Metab Dispos, 1998;26(8), 818-821
15
Picard N, et al.:Drug Metab Dispos, 2005;33(5), 689-695
16
Heel RC, et al.:Drugs, 1979;17(2), 81-110
17
Cone EJ, et al.:Drug Metab Dispos, 1984;12(5), 577-581
18
社内資料:ミダゾラムとの薬物相互作用の検討(2011年2月23日承認、CTD2.7.6.2.4.5)
19
社内資料:プロクロルペラジンとの薬物相互作用の検討(2011年2月23日承認、CTD2.7.6.2.4.6)
20
社内資料:ケトコナゾールとの薬物相互作用の検討(2011年2月23日承認、CTD2.7.6.2.4.7)
21
桧山隆司 他:日薬理誌, 1982;79(3), 147-162
22
社内資料:オピオイド受容体結合および機能試験(2011年2月23日承認、CTD2.6.2.2)
23
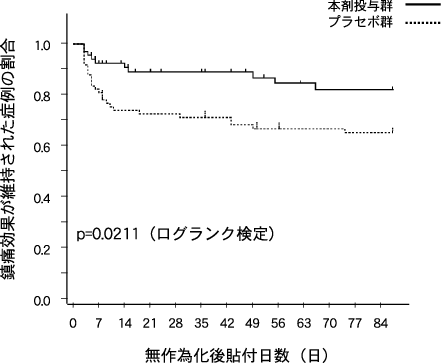
社内資料:変形性関節症 国内第Ⅲ相比較試験(2011年2月23日承認、CTD2.7.6.4.1.1)
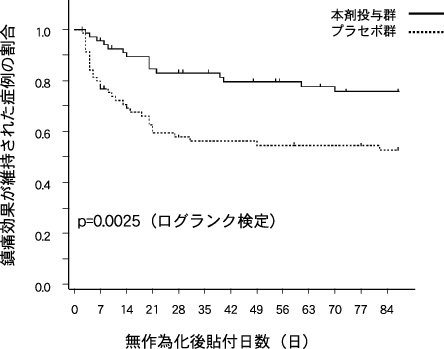
24
社内資料:慢性腰痛 国内第Ⅲ相比較試験(2011年2月23日承認、CTD2.7.6.4.1.2)