1
東純一ほか:基礎と臨床.1996;30(10):2587-2602.
2
東純一ほか:基礎と臨床.1996;30(10):2603-2616.
3
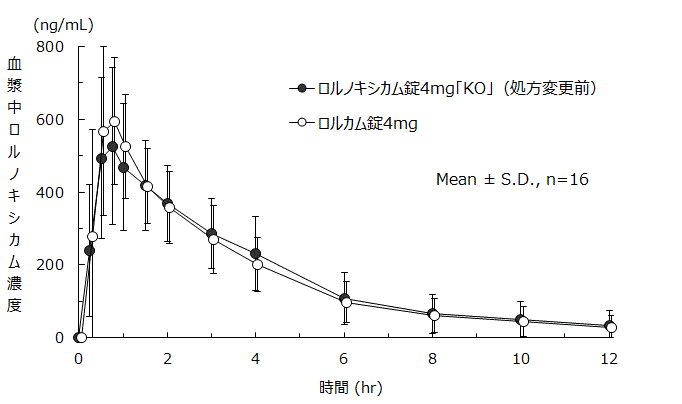
中村卓ほか:新薬と臨牀.2018;67(12):1493-1504.
4
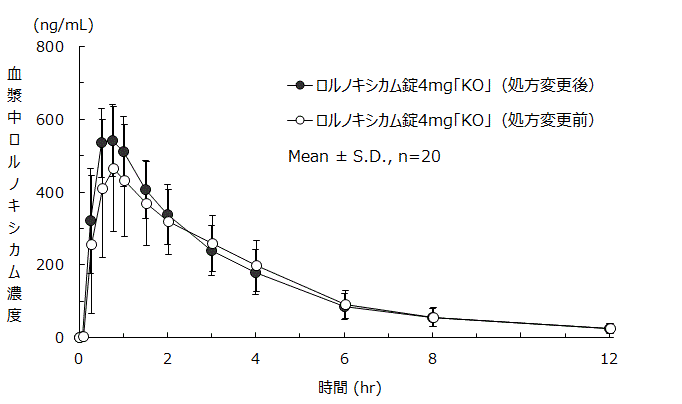
社内資料:ロルノキシカム錠4mg「KO」(処方変更後)の生物学的同等性試験.
5
浦野英俊ほか:基礎と臨床.1997;31(4):1415-1424.
6
浦野英俊ほか:基礎と臨床.1997;31(4):1401-1413.
7
浦野英俊ほか:基礎と臨床.1997;31(4):1441-1453.
8
ロルノキシカムの代謝に関与するヒトP450分子種の同定(ロルカム錠:2000年12月22日承認、申請資料概要ヘ 3.3)
9
ロルノキシカムの体内動態―ヒトにおける代謝―(ロルカム錠:2000年12月22日承認、申請資料概要ヘ 3.1)
10
社内資料:ロルノキシカム錠2mg「KO」(処方変更後)とロルノキシカム錠4mg「KO」(処方変更後)の生物学的同等性試験-溶出試験-
11
水島裕ほか:臨床医薬.2001;17(3):405-436.
12
水島裕ほか:炎症・再生.2001;21(3):243-272.
13
青木虎吉ほか:臨床医薬.1997;13(1):71-96.
14
青木虎吉ほか:炎症.1997;17(2):195-214.
15
廣畑和志ほか:臨床医薬.1997;13(4):923-946.
16
小野村敏信ほか:炎症.1997;17(3):275-294.
17
杉岡洋一ほか:臨床医薬.1997;13(4):947-971.
18
杉岡洋一ほか:炎症.1997;17(3):297-319.
19
道健一ほか:歯科薬物療法.1997;16(1):15-27.
20
道健一ほか:歯科薬物療法.1997;16(2):53-67.
21
二木伸子ほか:薬理と治療.1997;25(4):925-941.