1
厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
2
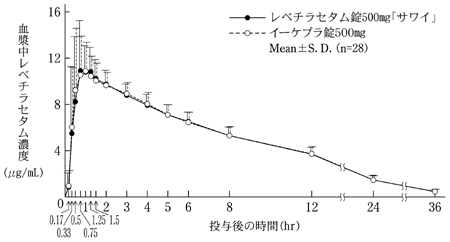
日本人健康成人におけるレベチラセタム単回投与時の薬物動態(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.3.1)
3
日本人健康成人におけるレベチラセタム反復投与時の薬物動態(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.3.2)
4
日本人健康成人におけるレベチラセタム錠及び注射剤の単回投与時の比較(イーケプラ点滴静注:2014年7月4日承認、申請資料概要 2.7.6.1.1)
5
外国小児てんかん患者におけるレベチラセタム単回投与時の薬物動態①(イーケプラ錠/ドライシロップ:2013年5月31日承認、申請資料概要 2.7.6.2.1)
6
外国小児てんかん患者におけるレベチラセタム単回投与時の薬物動態②(イーケプラ錠/ドライシロップ:2013年5月31日承認、審査報告書)
7
レベチラセタムに関する母集団薬物動態解析-1(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.2.2.3)
8
Toublanc, N. et al.:Drug Metab. Pharmacokinet., 2014;29:61-68
9
髙野和彦他:診療と新薬, 2021;58(9):649-655
10
日本人健康成人におけるレベチラセタムの薬物動態に及ぼす食事の影響(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.1.2)
11
Ramael, S. et al.:Clin. Ther., 2006;28:734-744
12
Strolin Benedetti, M. et al.:Eur. J. Clin. Pharmacol., 2003;59:621-630
13
分布(イーケプラ錠:2010年7月23日承認、申請資料概要 2.6.4.1, 2.6.4.4)
14
代謝(代謝経路)(イーケプラ錠:2010年7月23日承認、申請資料概要 2.4.3.3, 2.6.2.2)
15
代謝(薬物動態学的薬物相互作用)(イーケプラ錠:2010年7月23日承認、申請資料概要 2.6.4.7)
16
排泄(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.2.3.2)
17
Yamamoto, J. et al.:Clin. Drug Investig., 2014;34:819-828
18
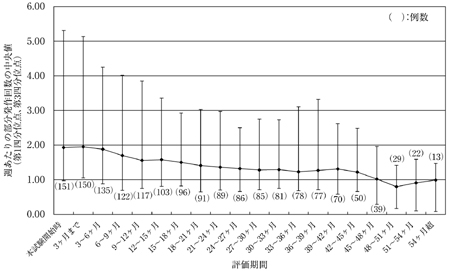
Brockmöller, J. et al.:Clin. Pharmacol. Ther., 2005;77:529-541
19
肝機能障害患者(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.4.5)
20
高齢者(外国人)におけるレベチラセタム単回及び反復経口投与時の薬物動態(イーケプラ錠:2010年7月23日承認、申請資料概要 2.5.3.4, 2.7.6.4.1)
21
Browne, T. R. et al.:J. Clin. Pharmacol., 2000;40:590-595
22
薬物相互作用(フェニトイン)(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.5.6)
23
Coupez, R. et al.:Epilepsia, 2003;44:171-178
24
Ragueneau-Majlessi, I. et al.:Epilepsia, 2002;43:697-702
25
薬物相互作用(経口避妊薬)(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.5.1)
26
Levy, R. H. et al.:Epilepsy Res., 2001;46:93-99
27
Ragueneau-Majlessi, I. et al.:Epilepsy Res., 2001;47:55-63
28
レベチラセタム及び代謝物の薬物動態に及ぼすプロベネシドの影響(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.5.4)
29
ドライシロップと錠剤の生物学的同等性試験(イーケプラ錠/ドライシロップ:2013年5月31日承認、申請資料概要 2.7.6.1.1)
30
社内資料:生物学的同等性試験(錠250mg)
31
日本における部分発作単剤療法の第Ⅲ相試験(イーケプラ錠/ドライシロップ/点滴静注:2015年2月20日承認、審査報告書)
32
日本における部分発作併用療法のプラセボ対照比較試験(国内第Ⅱ/Ⅲ相試験(成人、併用療法))(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.7.1)
33
日本における部分発作併用療法のプラセボ対照比較試験(国内第Ⅲ相試験(成人、併用療法))(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.7.2)
34
八木和一他:てんかん研究, 2012;29:441-454
35
国内長期継続投与試験①(イーケプラ錠:2010年7月23日承認、申請資料概要 2.7.6.8.1)
36
国内長期継続投与試験②(イーケプラ錠:2010年7月23日承認、審査報告書)
37
日本における部分発作併用療法の小児第Ⅲ相試験(イーケプラ錠/ドライシロップ:2013年5月31日承認、申請資料概要 2.7.6.4.2)
38
日本及び中国における強直間代発作併用療法のプラセボ対照比較試験(イーケプラ錠/ドライシロップ/点滴静注:2016年2月29日承認、申請資料概要 2.7.6.1.1)
39
日本における強直間代発作併用療法の小児第Ⅲ相試験(イーケプラ錠/ドライシロップ/点滴静注:2016年2月29日承認、申請資料概要 2.7.6.2.1)
40
日本における強直間代発作併用療法の長期継続投与試験①(イーケプラ錠/ドライシロップ/点滴静注:2016年2月29日承認、申請資料概要 2.7.6.2.2)
41
日本における強直間代発作併用療法の長期継続投与試験②(イーケプラ錠/ドライシロップ/点滴静注:2016年2月29日承認、審査報告書)
42
Noyer, M. et al.:Eur. J. Pharmacol., 1995;286:137-146
43
Lynch, B. A. et al.:Proc. Nat. Acad. Sci. U.S.A., 2004;101:9861-9866
44
Lukyanetz, E. A. et al.:Epilepsia, 2002;43:9-18
45
Pisani, A. et al.:Epilepsia, 2004;45:719-728
46
Rigo, J. M. et al.:Br. J. Pharmacol., 2002;136:659-672
47
Margineanu, D. G. et al.:Pharmacol. Res., 2000;42:281-285
48
Kaminski, R. M. et al.:Neuropharmacology, 2008;54:715-720
49
Klitgaard, H. et al.:Eur. J. Pharmacol., 1998;353:191-206
50
Gower, A. J. et al.:Epilepsy Res., 1995;22:207-213
51
Gower, A. J. et al.:Eur. J. Pharmacol., 1992;222:193-203
52
Löscher, W. et al.:J. Pharmacol. Exp. Ther., 1998;284:474-479
53
Lamberty, Y. et al.:Epilepsy Behav., 2000;1:333-342
54
Hanon, E. et al.:Seizure, 2001;10:287-293