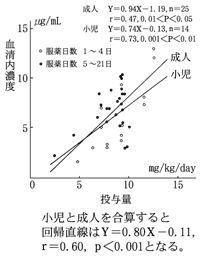
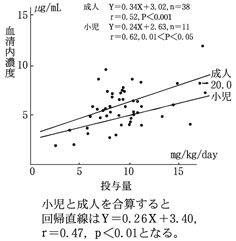
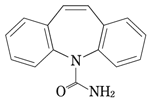
1
Jones, K. L. et al.:N. Engl. J. Med.,1989,320(25),1661-1666
2
Kaneko, S. et al.:Epilepsia,1988,29(4),459-467
3
日本チバガイギー医薬品「過量使用時の症状と処置」日本チバガイギー株式会社・医薬情報部編集, 1987, p. 41
4
Ozeki, T. et al.:Hum. Mol. Genet.,2011,20(5),1034-1041
5
Middleton, D. et al.:Tissue Antigens,2003,61(5), 403-407(2013年11月19日現在)
6
Chung, W.H. et al.:Nature,2004,428(6982),486
7
Hung, S.I. et al.:Pharmacogenet. Genomics,2006,16(4),297-306
8
鈴木喜八郎ほか:脳と神経,1978,30(12),1293-1302
9
Bertilsson, L.:Clin. Pharmacokin.,1978,3(2),128-143
10
Levy, R. H. et al.:Clin. Pharmacol. Ther.,1975,17(6),657-668
11
Hvidberg, E. F. et al.:Clin. Pharmacokin.,1976,1(3),161-188
12
Morselli, P. L. et al.:Pharmacol. Ther.,1980,10(1),65-101
13
Faigle, J. W. et al.:“Antiepileptic Drugs,”2nd Edition,1982,483-495
14
大熊輝雄ほか:精神医学,1987,29(11),1211-1226
15
大熊輝雄ほか:精神医学,1981,23(4),379-389
16
Okuma. T. et al.:Psychopharmacology,1979,66(3),211-217
17
渡辺一功ほか:難治てんかんの治療法開発に関する研究 平成6年度研究報告書,1995,143-145
18
岡田元宏:医学のあゆみ,2000,193(6),581-585
19
Theobald, W. et al.:Arzneim.-Forsch.,1963,13(2),122-125
20
佐藤光源ほか:脳と神経,1975,27(3),257-273
21
小林清史ほか:脳と神経,1967,19(10),999-1005
22
Hernández-Peón, R.:Proc. 3rd Meet. CINP, Munich, Sept. 1962, Elsevier, Amst. 1964,303-311
23
Nakao, K. et al.:Jpn. J. Pharmacol.,1985,39(2),281-283
24
中尾健三ほか:薬理と治療,1988,16(3),1189-1190
25
中尾健三ほか:薬理と治療,1988,16(3),1191-1206
26
Hernández-Peón, R.:Med. Pharmacol. Exp.,1965,12(2),73-80