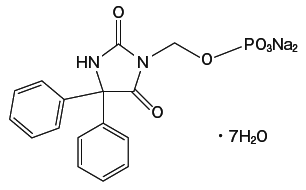
1
鈴木喜八郎, 他: 周産期医学. 1979; 9: 1259-64
2
Veronese ME, et al.: Biochem Biophys Res Commun. 1991; 175: 1112-8
3
Bajpai M.: Drug Metab Dispos. 1996; 24: 1401-3
4
Faucette SR, et al.: Drug Metab Dispos. 2004; 32: 348-58
5
社内資料:第I相試験(臨床薬物動態試験)(2011年7月1日承認、申請資料概要2.7.2.2.2)
6
社内資料:第III相試験(安全性、有効性及び薬物動態の検討)(2011年7月1日承認、申請資料概要2.7.2.3.5、2.7.6.2.1)
7
社内資料:漸増投与臨床薬物動態試験(RR744-00086)(2011年7月1日承認、申請資料概要2.7.2.2.2、2.7.2.3.7)
8
社内資料:フェニトイン対照臨床薬物動態試験(RR744-00152)(2011年7月1日承認、申請資料概要2.7.2.2.2、2.7.2.3.7)
9
Aweeka F, et al.: Am Soc Clin Pharm Ther. 1989: 152(PIIK-2)
10
Hussey EK, et al.: Pharm Res. 1988: S-214(PP1463)
11
Hussey EK, et al.: Pharmacotherapy. 1989 ACCP ABSTRACTS: 195-6(151E, 152E)
12
Hussey EK, et al.: Pharm Res. 1990; 7: 1172-6
13
Swinyard EA.: J Am Pharm Assoc. 1949; 38: 201-4
14
Swinyard EA, et al.: J Pharmacol Exp Ther. 1952; 106: 319-30
15
Goodman LS, et al.: J Pharmacol Exp Ther. 1953; 108: 168-76
16
Rall TW & Schleifer LS.: GOODMAN & GILMAN's The Pharmacological Basis of Therapeutics, 8th ed. Pergamon Press. 1990: 436-62
17
Korey SR.: Proc Soc Exp Biol Med. 1951; 76: 297-9
18
Esplin DW.: J Pharmacol Exp Ther. 1957; 120: 301-23
19
Toman JEP.: Neurology. 1951; 1: 444-60
20
Ensor CR, et al.: Proc Soc Exp Biol Med. 1959; 100: 133-5