1
沢田英夫ほか:岐阜大学医学部紀要. 1973;21:248-259
2
Ochs HR, et al.:Clin. Pharmacol. Ther. 1987;41:562-570
3
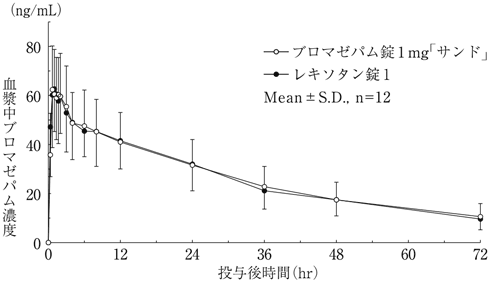
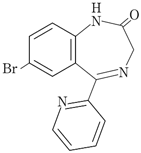
社内資料:生物学的同等性試験(ブロマゼパム錠1mg「サンド」)
4
Kaplan SA, et al.:J. Pharmacokinet. Biopharm. 1976;41:1-16
5
伊藤 斉ほか:臨床評価. 1983;11:155-199
6
西園昌久ほか:臨牀と研究. 1973;50:1741-1754
7
大熊輝雄ほか:精神医学. 1973;15:753-769
8
野村喜重郎ほか:臨牀と研究. 1982;59:2048-2061
9
筒井末春ほか:薬理と治療. 1981;9:2105-2117
10
伊東和人ほか:診療と保険. 1973;15:600-609
11
岡田敏一:神経精神薬理. 1980;2:5-16
12
植木昭和ほか:医学研究. 1973;43:41-58