1
社内資料:ウサギにおける初期胚発生に関する試験(承認年月日:2007年1月26日、申請資料概要ニ.3.1)[L20061116003]
2
社内資料:ウサギにおける胚・胎児発生に関する試験(承認年月日:2007年1月26日、申請資料概要ニ.3.3)[L20061116004]
3
社内資料:プラセボ対照、多施設、無作為、二重盲検比較試験(承認年月日:2007年1月26日、申請資料概要ト.3.2.4.1)[L20061116002]
4
社内資料:第Ⅰ相単回用量漸増試験(承認年月日:2007年1月26日、申請資料概要ヘ.3.1.2)[L20061116005]
5
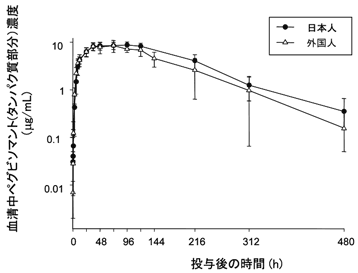
社内資料:第Ⅰ相臨床試験 -単回投与試験-(承認年月日:2007年1月26日、申請資料概要ヘ.3.1.1)[L20061116006]
6
社内資料:ポピュレーションファーマコキネティクス解析(補足)(承認年月日:2007年1月26日、申請資料概要ヘ.3.2.7)[L20061116008]
7
社内資料:Population Pharmacokinetic/pharmacodynamic analysis of a growth hormone receptor antagonist,pegvisomant,in Japanese and western acromegaly patients(承認年月日:2007年1月26日、申請資料概要ヘ.3.2.10)[L20061116009]
8
社内資料:絶対バイオアベイラビリティ及び薬物動態(承認年月日:2007年1月26日、申請資料概要ヘ.3.1.3)[L20061116007]
9
社内資料:放射性標識体投与時の組織内分布及び排泄(承認年月日:2007年1月26日、申請資料概要ヘ.2.2.2)[L20061116010]
10
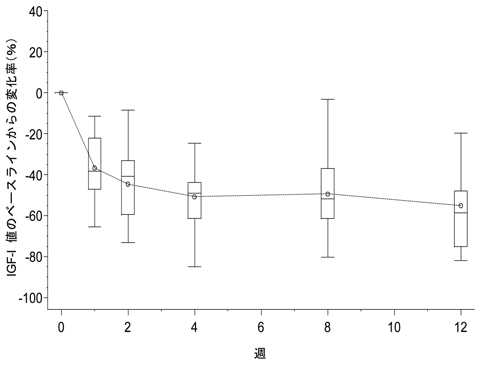
社内資料:多施設共同、非対照、非盲検試験(有効性及び安全性の検討)(承認年月日:2007年1月26日、申請資料概要ト.3.1.2)[L20061116011]
11
社内資料:長期投与試験(承認年月日:2007年1月26日、申請資料概要ト.3.1.3)[L20061116012]
12
社内資料:オープン・延長試験(承認年月日:2007年1月26日、申請資料概要ト.3.2.4.2)[L20061116014]
13
社内資料:オープン試験(承認年月日:2007年1月26日、申請資料概要ト.3.2.4.3)[L20061116015]
14
社内資料:肝臓成長ホルモン受容体へのB2036-PEGの結合(承認年月日:2007年1月26日、申請資料概要ホ.1.1.1)[L20061116023]
15
Goffin,V.et al.:Endocrinology.1999;140(8):3853-3856
16
社内資料:Evaluation of binding activity of B2036-PEG(承認年月日:2007年1月26日、申請資料概要ホ.1.1.3)[L20061116024]
17
社内資料:サルにおける成長ホルモンアンタゴニストの作用(承認年月日:2007年1月26日、申請資料概要ホ.1.2.1)[L20061116016]
18
社内資料:アカゲザルにおける薬物動態及び薬効薬理(承認年月日:2007年1月26日、申請資料概要ホ.1.2.1)[L20061116017]
19
社内資料:ウサギにおける皮膚刺激性試験(承認年月日:2007年1月26日、申請資料概要ホ.1.2.2)[L20061116018]
20
社内資料:ウサギにおける胚・胎児発生に関する用量設定試験(承認年月日:2007年1月26日、申請資料概要ニ.3.2)[L20061116019]
21
社内資料:マウスにおける薬物動態及び薬効薬理(承認年月日:2007年1月26日、申請資料概要ホ.1.2.3)[L20061116020]
22
社内資料:A Study of the Pharmacokinetics and Pharmacodynamics of Growth Hormone Antagonists in Mice(承認年月日:2007年1月26日、申請資料概要ホ.1.2.3)[L20061116022]