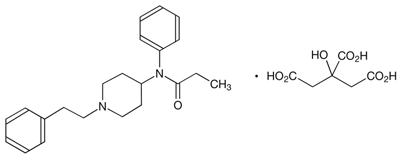
癌疼痛治療剤
1錠 549円
| 直径(mm) | 6 |
|---|---|
| 厚さ(mm) | 2 |
| 重量(g) | 0.07 |
| 外形 |  |
| 色調剤皮 | 白色、素錠 |
| 識別記号 | KH11(錠剤本体、SPシートに表示) |
| 直径(mm) | 6 |
|---|---|
| 厚さ(mm) | 2 |
| 重量(g) | 0.07 |
| 外形 |  |
| 色調剤皮 | まだらをもつごくうすい黄色、素錠 |
| 識別記号 | KH12(錠剤本体、SPシートに表示) |
| 直径(mm) | 6 |
|---|---|
| 厚さ(mm) | 2 |
| 重量(g) | 0.07 |
| 外形 |  |
| 色調剤皮 | まだらをもつうすい帯黄赤色、素錠 |
| 識別記号 | KH13(錠剤本体、SPシートに表示) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| **ナルメフェン塩酸塩水和物(セリンクロ) | ナルメフェン塩酸塩水和物はオピオイド受容体作動薬の鎮痛作用を減弱させるため、効果を得るために必要な本剤の用量が通常用量より多くなるおそれがある。 | μオピオイド受容体拮抗作用により、μオピオイド受容体作動薬に対して競合的に阻害する。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 中枢神経抑制剤(フェノチアジン系薬剤、ベンゾジアゼピン系薬剤、バルビツール酸系薬剤等)、吸入麻酔剤、モノアミン酸化酵素阻害剤、三環系抗うつ剤、骨格筋弛緩剤、鎮静性抗ヒスタミン剤、アルコール、オピオイド系薬剤 | 呼吸抑制、低血圧、めまい、口渇及び顕著な鎮静又は昏睡が起こることがあるので、減量するなど慎重に投与すること。 | 相加的に中枢神経抑制作用が増強する。 |
| セロトニン作用薬、選択的セロトニン再取り込み阻害剤(SSRI)、セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)、モノアミン酸化酵素阻害剤等 | セロトニン症候群(不安、焦燥、興奮、錯乱、発熱、発汗、頻脈、振戦、ミオクローヌス等)があらわれるおそれがある。 | 相加的にセロトニン作用が増強するおそれがある。 |
| CYP3A4を阻害する薬剤(リトナビル、イトラコナゾール、アミオダロン、クラリスロマイシン、ジルチアゼム塩酸塩、フルボキサミンマレイン酸塩等) | フェンタニルのAUCの増加、血中半減期の延長が認められたとの報告がある。呼吸抑制等の副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | 肝CYP3A4に対する阻害作用により、本剤の代謝が阻害される。 |
| グレープフルーツジュース | 本剤の血中濃度を上昇させるおそれがある。 | CYP3A4に対する阻害作用により、本剤の代謝が阻害される。 |
| CYP3A4を誘導する薬剤(リファンピシン、フェニトイン等) | 本剤の血中濃度を低下させるおそれがある。また、CYP3A4誘導剤を中止又は減量する場合は、本剤の効果が増強する可能性があるため、本剤の用量を適宜調節すること。 | 肝CYP3A4に対する誘導作用により、本剤の代謝が促進される。 |
| キニジン | 本剤の血中濃度を上昇させるおそれがある。 | P糖蛋白及びCYP3A4に対する阻害作用により、本剤の吸収が増加し代謝が阻害される。 |
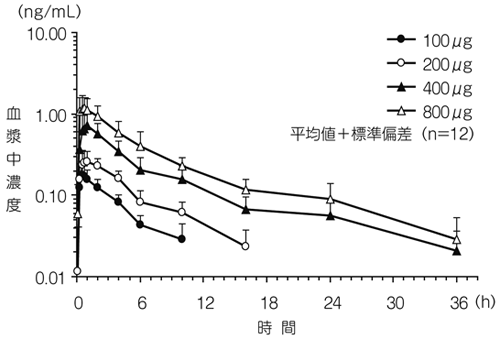
| 投与量 | tmax* (h) | Cmax (ng/mL) | AUC0〜∞ (ng・h/mL) | t1/2 (h) |
| 100μg | 0.50 (0.31-2.00) | 0.187±0.061 | 0.974±0.332 | 5.02±2.58 |
| 200μg | 0.87 (0.27-4.00) | 0.302±0.092 | 1.92±0.53 | 6.67±2.01 |
| 400μg | 1.00 (0.50-1.99) | 0.765±0.288 | 5.49±1.93 | 13.5±5.0 |
| 800μg | 0.50 (0.25-1.00) | 1.42±0.47 | 8.95±2.97 | 10.1±3.4 |
| 段階 | 用量注) | 追加投与量注) |
| 1 | 100μg | 100μg |
| 2 | 200μg | 100μg |
| 3 | 300μg | 100μg |
| 4 | 400μg | 200μg |
| 5 | 600μg | 200μg |
| 6 | 800μg | ─ |
| 本剤 | プラセボ | |
| PID30*(mm) | 41.11±23.03 | 33.85±25.39 |
| PID30**(mm) | 41.20 [37.40, 45.00] | 34.01 [29.41, 38.61] |
| 本剤とプラセボとの差**(mm) | 7.19 [2.59, 11.79] | 7.19 [2.59, 11.79] |
| 本剤とプラセボとの差**(mm) | p=0.002 | p=0.002 |