遺伝子組換えヒト型甲状腺刺激ホルモン製剤
1瓶 106865円
| 本剤は白色〜類白色の凍結乾燥粉末又は塊である。本剤1バイアルをとり、日局注射用水1.2mLを加えて溶かすとき、無色澄明な液で異物を認めない。 |
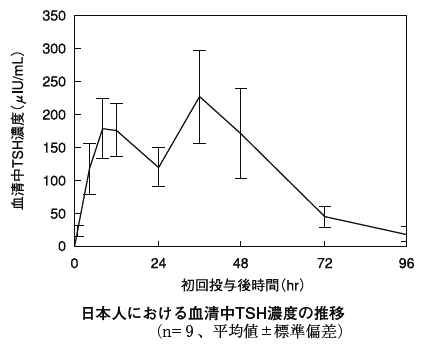
| Tmax(時間) | Cmax(μIU/mL) | |
| 日本人(9例) | 28.75±14.21 | 240.8±65.9 |
| 外国人(3例) | 28.0(3例とも28.0) | 220.3±45.6 |
| 放射性ヨウ素シンチグラムの優劣評価 | (10例) |
| 優れている(本剤投与>甲状腺ホルモン投与中止法) | 0例 (0%) |
| 同等(本剤投与=甲状腺ホルモン投与中止法) | 7例 (70%) |
| 劣っている(本剤投与<甲状腺ホルモン投与中止法) | 3例 (30%) |
| 同等以上(本剤投与≧甲状腺ホルモン投与中止法) | 7例 (70%) |
| 放射性ヨウ素シンチグラムの優劣評価 | (113例) |
| 優れている(本剤投与>甲状腺ホルモン投与中止法) | 3例 (2.7%) |
| 同等(本剤投与=甲状腺ホルモン投与中止法) | 101例 (89.4%) |
| 劣っている(本剤投与<甲状腺ホルモン投与中止法) | 9例 (8.0%) |
| 同等以上(本剤投与≧甲状腺ホルモン投与中止法) | 104例 (92.0%) |
| 群 | 平均年齢 (歳) | 性別 (女性:男性) | 癌タイプ (乳頭:濾胞) | アブレーション奏効基準(8ヵ月後測定) 0.1%未満の取込み | アブレーション奏効基準(8ヵ月後測定) 目視的取込みなし |
| 本剤投与群 | 44 | 26:7 | 30:3 | 32/32 (100%) | 24/32 (75%) |
| 甲状腺ホルモン中止法 | 43 | 24:6 | 29:1 | 28/28 (100%) | 24/28 (86%) |
| 甲状腺床への取込み | 本剤投与法 (n=25) | 甲状腺ホルモン中止法 (n=18) |
| 目視的取込みなし及び0.1%未満の取込み | 25例(100%) | 18例(100%) |