1
社内資料: ラット胚・胎児発生に関する試験(2015年3月26日承認、CTD2.6.6.6.2.1)
2
社内資料: ウサギ胚・胎児発生に関する試験(2015年3月26日承認、CTD2.6.6.6.2.2)
3
社内資料: 生殖発生毒性試験の無毒性量と予定臨床用量の動態パラメータ比較(2015年3月26日承認、CTD2.6.6.6.4)
4
社内資料: サル胚・胎児発生に関する試験(2015年3月26日承認、CTD2.6.6.6.2.3)
5
社内資料: 2~17歳の患者の第Ⅰ/Ⅲ相試験(2015年3月26日承認、CTD2.7.6.8)
6
社内資料: 2歳未満の患者の第Ⅰ相試験(2015年3月26日承認、CTD2.7.6.22)
7
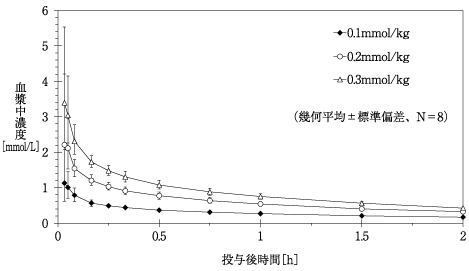
社内資料: 健康成人の薬物動態試験(2015年3月26日承認、CTD2.7.6.1)
8
社内資料: 血漿タンパク結合試験(2015年3月26日承認、CTD2.6.4.4.3)
9
社内資料: 外国人健康成人男性を対象とした単回投与試験(2015年3月26日承認、CTD2.7.2.2.2.5)
10
社内資料: 腎障害患者の薬物動態試験(2015年3月26日承認、CTD2.7.6.6)
11
社内資料: 高齢者の薬物動態試験(2015年3月26日承認、CTD2.7.6.7)
12
Katakami N, et al.: Invest Radiol. 2011; 46: 411-418
13
社内資料: 国内第Ⅲ相非盲検試験(2015年3月26日承認、CTD2.7.6.9)
14
Gutierrez JE, et al.: J Magn Reson Imaging. 2015; 41: 788-796
15
Kuwatsuru R, et al.: J Magn Reson Imaging. 2015; 41: 404-413
16
倉内万佐代他: 画像診断. 1988; 8: 450-453
17
Brasch RC: Radiology. 1983; 147: 781-788