1
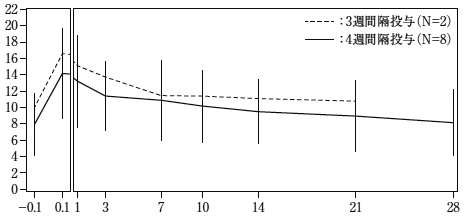
社内資料:臨床薬理試験(2020年2月21日承認、CTD2.7.2.2)
2
社内資料:臨床薬理試験(2019年3月26日承認、CTD2.7.2.2)
3
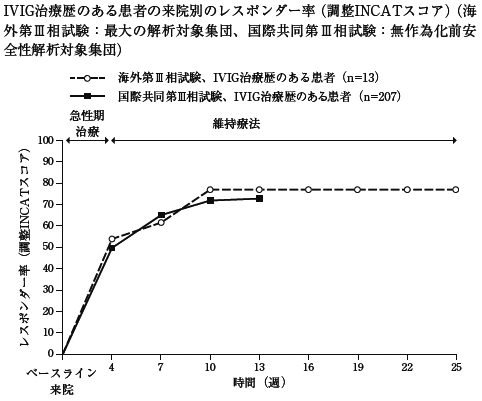
社内資料:臨床概要(2020年2月21日承認、CTD2.7.3.2及び2.7.4.2)
4
社内資料:臨床概要(2019年3月26日承認、CTD2.7.3.3、2.7.4.2及び2.7.4.3)
5
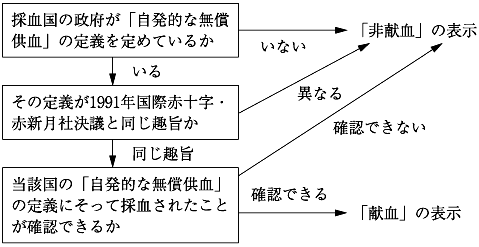
Cramer. M., et al.:Vox Sanguinis 96, 219, 2009
6
社内資料:非臨床試験の概括評価(2019年3月26日承認、CTD2.4.2.1)