作成又は改訂年月
*
2019年5月改訂
(第2版)(下線:改訂箇所)
2019年3月作成
(第1版)
日本標準商品分類番号
日本標準商品分類番号等
薬効分類名
承認等
販売名
ラビピュール筋注用
販売名コード
承認・許可番号
23100AMX00298
Rabipur
薬価基準収載年月
*2019年5月
(健保等一部限定適用)
販売開始年月
貯法・使用期限等
貯法
遮光して、2〜8℃に保存(【取扱い上の注意】参照)
有効期間
製造日から4年(最終有効年月日は外箱等に表示)
基準名
日本薬局方 生物学的製剤基準
乾燥組織培養不活化狂犬病ワクチン
規制区分
生物由来製品
劇薬
処方箋医薬品
注意−医師等の処方箋により使用すること
製法の概要及び組成・性状
製法の概要
本剤は、狂犬病ウイルス(Flury LEP株)をニワトリ胚初代培養細胞で増殖させ、得られたウイルスをβ-プロピオラクトンで不活化した後、しょ糖密度勾配遠心で濃縮・精製し、安定剤を加え充填・凍結乾燥したものである。
なお、本剤は製造工程でウシの乳由来成分(トリプトースリン酸ブイヨン)、ウシの血液由来成分(ウシ胎児血清)、ブタに由来する成分(トリプトースリン酸ブイヨン、トリプシン)、ニワトリの発育鶏卵及びヒトの血液由来成分(ヒト血清アルブミン)を使用している。
組成
本剤を添付の溶剤(日本薬局方注射用水)全量で溶解したとき、液剤1.0mL中に次の成分・分量を含有する。
有効成分
不活化狂犬病ウイルス(Flury LEP株) 参照品と同等以上
添加物
L-グルタミン酸カリウム水和物 0.8〜1.0mg
ポリゼリン注) 9.0〜12.0mg
塩化ナトリウム 4.0〜5.0mg
トロメタモール 3.0〜4.0mg
エデト酸ナトリウム水和物 0.2〜0.3mg
pH調節剤 適量
注)ゼラチンの分解物を重合させたゼラチン由来物質である。
性状
| 製剤の性状 | 本剤は、不活化した狂犬病ウイルスを含む白色又は微黄白色の乾燥製剤である。
添付の溶剤全量を加えるとき、無色又は淡黄赤色の澄明又はわずかに白濁した液剤となる。 |
|---|
| pH | 7.3〜8.3 |
|---|
| 浸透圧比(生理食塩液に対する比) | 1〜3 |
|---|
接種不適当者
(予防接種を受けることが適当でない者)
被接種者が次のいずれかに該当すると認められる場合には、接種を行ってはならない。
明らかな発熱を呈している者
重篤な急性疾患にかかっていることが明らかな者
本剤の成分によってアナフィラキシーを呈したことがあることが明らかな者
上記に掲げる者のほか、予防接種を行うことが不適当な状態にある者
ただし、曝露後免疫を目的とした使用に限り、予防接種上の有益性を考慮して接種を行うこと。
効能又は効果
効能又は効果/用法及び用量
用法及び用量
本剤を添付の溶剤(日本薬局方注射用水)の全量で溶解し、次のとおり使用する。
曝露前免疫
1.0mLを1回量として、適切な間隔をおいて3回筋肉内に接種する。
曝露後免疫
1.0mLを1回量として、適切な間隔をおいて4〜6回筋肉内に接種する。
用法及び用量に関連する接種上の注意
曝露前免疫及び曝露後免疫の接種日の目安等は以下のとおりである。なお、接種要否及び接種スケジュールは世界保健機関(WHO)の推奨1)も参考に検討すること。
<曝露前免疫(狂犬病の予防)>
接種日の目安(1回目接種日を0日とする。)
3回接種
接種日の目安:0、7、21日又は0、7、28日
他のワクチン製剤との接種間隔
生ワクチンの接種を受けた者は、通常、27日以上、また、他の不活化ワクチンの接種を受けた者は、通常、6日以上間隔をおいて本剤を接種すること。ただし、医師が必要と認めた場合には、同時に接種することができる(なお、本剤を他のワクチンと混合して接種してはならない)。
<曝露後免疫(狂犬病の発病阻止)>
接種日の目安(1回目接種日を0日とする。)
4回接種
接種日の目安:0(接種部位を変えて、2箇所に1回ずつ、計2回)、7、21日
5回接種
接種日の目安:0、3、7、14、28日
6回接種
接種日の目安:0、3、7、14、30、90日
咬傷等の曝露を受けた場合には、以前に曝露前免疫を完了した者であっても、必ず曝露後免疫を行うこと。
接種上の注意
接種要注意者
(接種の判断を行うに際し、注意を要する者)
被接種者が次の(1)〜(7)いずれかに該当すると認められる場合は、健康状態及び体質を勘案し、診察及び接種適否の判断を慎重に行い、予防接種の必要性、副反応、有用性について十分な説明を行い、同意を確実に得た上で、注意して接種すること。
ゼラチン含有製剤又はゼラチン含有の食品に対して過敏症の既往歴のある者
心臓血管系疾患、腎臓疾患、肝臓疾患、血液疾患、発育障害等の基礎疾患を有する者
予防接種で接種後2日以内に発熱のみられた者及び全身性発疹等のアレルギーを疑う症状を呈したことがある者
過去にけいれんの既往のある者
過去に免疫不全の診断がなされている者及び近親者に先天性免疫不全症の者がいる者
本剤の成分又は鶏卵、鶏肉、その他鶏由来のもの、テトラサイクリン、ネオマイシン、アムホテリシンBに対してアレルギーを呈するおそれのある者
血小板減少症や凝固障害を有する者、抗凝固療法を施行している者[筋肉内接種により出血するおそれがある。]
重要な基本的注意
本剤は、「予防接種実施規則」及び「定期接種実施要領」に準拠して使用すること。
被接種者について、接種前に必ず問診、検温及び診察(視診、聴診等)によって健康状態を調べること。
本剤は安定剤としてゼラチンの分解物を重合させたゼラチン由来物質(ポリゼリン)を含有している。ゼラチン含有製剤の接種により、ショック、アナフィラキシー(蕁麻疹、呼吸困難、口唇浮腫、喉頭浮腫等)があらわれたとの報告があるので、問診を十分に行い、接種後は観察を十分に行うこと。
被接種者又はその保護者に、接種当日は過激な運動は避け、接種部位を清潔に保ち、また、接種後の健康監視に留意し、局所の異常反応や体調の変化、さらに高熱、けいれん等の異常な症状を呈した場合には速やかに医師の診察を受けるよう事前に知らせること。
ワクチン接種直後又は接種後に注射による心因性反応を含む血管迷走神経反射として失神があらわれることがある。失神による転倒を避けるため、接種後30分程度は座らせるなどした上で被接種者の状態を観察することが望ましい。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
免疫抑制剤(副腎皮質ステロイド等)等との関係
免疫抑制的な作用を持つ製剤の投与を受けている者、特に長期あるいは大量投与を受けている者は免疫機能が低下しているため本剤の効果が得られないおそれがあるので、併用に注意すること。 |
|---|
副反応
副反応等発現状況の概要
<曝露前免疫>
20歳以上65歳未満の健康人を対象とした国内第III相試験において、筋肉内3回接種による副反応は109例中67例(61.5%)であった。主な副反応は、注射部位疼痛47例(43.1%)、注射部位紅斑18例(16.5%)、倦怠感15例(13.8%)であった(承認時)。
20歳未満の健康人を対象とした国内第II/III相試験において、筋肉内3回接種による副反応は34例中23例(67.6%)であった。主な副反応は、注射部位疼痛19例(55.9%)、頭痛9例(26.5%)、注射部位紅斑7例(20.6%)、注射部位そう痒感7例(20.6%)、筋肉痛6例(17.6%)、注射部位腫脹4例(11.8%)、疲労4例(11.8%)であった(承認時)。
<曝露後免疫>
6歳以上17歳以下及び51歳以上の健康人を対象とした海外第III相試験において、Essen法又はZagreb法※により本剤が接種された。6歳以上17歳以下のEssen群では119例中61例(51%)に副反応が認められ、主な副反応は注射部位疼痛47例(40%)、疲労15例(13%)、筋肉痛13例(11%)、Zagreb群では121例中63例(52%)に副反応が認められ、主な副反応は注射部位疼痛45例(38%)、疲労18例(15%)、食欲減退14例(12%)であった。51歳以上のEssen群では200例中47例(24%)に副反応が認められ、主な副反応は注射部位疼痛22例(11%)、頭痛8例(4%)、疲労7例(4%)、Zagreb群では200例中38例(19%)に副反応が認められ、主な副反応は注射部位疼痛18例(9%)、疲労9例(5%)、頭痛7例(4%)であった。
18歳以上50歳以下の健康人を対象とした海外第IV相試験において、Essen法又はZagreb法により本剤が接種された。Essen群では123例中13例(11%)に副反応が認められ、主な副反応は注射部位疼痛8例(7%)、発熱3例(2%)、Zagreb群では126例中5例(4%)に副反応が認められ、主な副反応は注射部位疼痛3例(2%)、発熱3例(2%)であった。
※)Essen法:1回目接種日を0日とし、0、3、7、14、28日に接種(5回接種)
Zagreb法:1回目接種日を0日とし、0(接種部位を変えて、2箇所に1回ずつ、計2回)、7、21日に接種(4回接種)
重大な副反応
ショック、アナフィラキシー
(頻度不明注))
ショック、アナフィラキシーがあらわれることがあるので、接種後は観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
脳炎
(頻度不明注))
脳炎があらわれることがあるので、観察を十分に行い、異常が認められた場合には、MRI等で診断し、適切な処置を行うこと。
ギラン・バレー症候群
(頻度不明注))
ギラン・バレー症候群があらわれることがあるので、四肢遠位から始まる弛緩性麻痺、腱反射の減弱ないし消失等の症状があらわれた場合には適切な処置を行うこと。
その他の副反応
局所反応(注射部位)
10%以上
疼痛、紅斑
局所反応(注射部位)
1〜10%未満
そう痒感、腫脹、硬結、内出血
皮膚
1〜10%未満
蕁麻疹
皮膚
1%未満
紅斑、そう痒性皮疹、顔面腫脹
皮膚
頻度不明注)
発疹、多汗症、血管浮腫
精神神経系
10%以上
頭痛
精神神経系
1〜10%未満
感覚鈍麻
精神神経系
頻度不明注)
浮動性めまい、錯感覚、失神寸前の状態、失神
消化器
1〜10%未満
悪心、下痢、嘔吐
消化器
1%未満
腹痛、食欲減退
消化器
頻度不明注)
腹部不快感
筋骨格
1〜10%未満
筋肉痛、関節痛、重感
筋骨格
1%未満
四肢不快感
その他
10%以上
倦怠感
その他
1〜10%未満
疲労、発熱、局所腫脹
その他
1%未満
口腔咽頭痛
その他
頻度不明注)
無力症、リンパ節症、過敏症、悪寒、回転性めまい
なお、頻度は国内臨床試験の集計結果による。
注)海外のみ認められている副反応であり、頻度不明とした。
高齢者への接種
一般に高齢者では、生理機能が低下しているので、接種に当たっては、予診等を慎重に行い、被接種者の健康状態を十分に観察すること。
妊婦、産婦、授乳婦等への接種
妊娠中の接種に関する安全性は確立していないので、妊婦又は妊娠している可能性のある婦人には予防接種上の有益性が危険性を上回ると判断される場合にのみ接種すること。
接種時の注意
接種時
本剤は筋肉内注射のみに使用し、皮下注射又は静脈内注射はしないこと。
容器の栓及びその周囲をアルコールで消毒した後、注射針をさし込み、所要量を注射器内に吸引する。この操作に当たっては、雑菌が迷入しないよう注意する。また、栓を取り外し、あるいは他の容器に移し使用してはならない。
注射針の先端が血管内に刺入していないことを確認すること。
注射針及び注射筒は被接種者毎に取り換えること。
本剤は、他剤と混合しないこと。
混濁、着色、異物の混入、その他の異常がないかを確認し、異常を認めたものは使用しないこと。
【ラビピュール筋注用の使用方法】に従い接種を行うこと。
接種部位
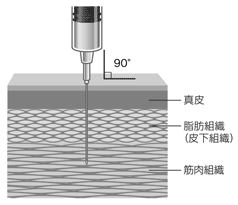
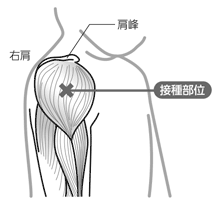
接種部位は、通常、大腿前外側部又は上腕三角筋とし、臀部には接種しないこと。
接種部位はアルコールで消毒し、同一部位に反復して接種することは避けること。
筋肉内注射に当たっては、組織・神経等への影響を避けるため下記の点に注意すること。
・針長は筋肉内接種に足る長さであるが、組織や血管あるいは骨に到達しないよう、各接種者に対して適切な針長を決定すること。
・神経走行部位を避けること。
・注射針を刺入したとき、激痛の訴えや血液の逆流がみられた場合は直ちに針を抜き、部位をかえて注射すること。
臨床成績
曝露前免疫(国内臨床試験)
20歳以上65歳未満の健康人109例を対象として、本剤1.0mLを0、7、28日の計3回筋肉内に接種した。本剤3回接種後の中和抗体保有率※は99.0%、中和抗体価の幾何平均抗体価は6.44IU/mLであった。
20歳未満の健康人34例を対象として、本剤1.0mLを0、7、28日の計3回筋肉内に接種した。本剤3回接種後の中和抗体保有率は100.0%、中和抗体価の幾何平均抗体価は10.71IU/mLであった。
※)中和抗体保有率の閾値:中和抗体価として0.5IU/mL以上
曝露後免疫(海外臨床試験)
6歳以上17歳以下の健康人240例及び51歳以上の健康人400例を対象として、本剤1.0mLをEssen法又はZagreb法※※で筋肉内に接種した。本剤初回接種後14日目の中和抗体価の幾何平均抗体価は、6歳以上17歳以下では14IU/mL(Essen法)及び12IU/mL(Zagreb法)であり、51歳以上では7.89IU/mL(Essen法)及び8.57 IU/mL(Zagreb法)であった。
18歳以上の健康人249例を対象として、本剤1.0mLをEssen法又はZagreb法で筋肉内に接種した。本剤初回接種後14日目の中和抗体価の幾何平均抗体価はいずれも12IU/mLであった。
※※)Essen法:1回目接種日を0日とし、0、3、7、14、28日に接種(5回接種)
Zagreb法:1回目接種日を0日とし、0(接種部位を変えて、2箇所に1回ずつ、計2回)、7、21日に接種(4回接種)
[参考情報]
狂犬病の疑いがある動物又は狂犬病と確認されている動物と72時間以内に接触した者(顔、手、首又は指を咬まれた場合は24時間以内)57例(抗狂犬病免疫グロブリン(国内未承認)を投与された者を含む)を対象に、本剤1.0mLを0、3、7、14、30、90日の計6回筋肉内に接種した。観察期間(平均値352日、中央値376日)において、狂犬病を発症した被験者は認められなかった。
薬効薬理
狂犬病動物に咬まれた後でも速やかに抗血清(中和抗体)を注射すれば発病阻止に有効であるので、狂犬病ワクチン接種により産生される液性免疫(中和抗体)が有効となる2)。
取扱い上の注意
保存時
溶剤が凍結すると容器が破損することがある。
接種時
本剤の溶解は接種直前に行い、一度溶解したものは直ちに使用すること。
承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
包装
瓶入 1回分:1本
溶剤(日本薬局方注射用水)1mL:1本添付
主要文献及び文献請求先
主要文献
1
World Health Organization(WHO). Expert Consultation on Rabies. WHO Technical Report Series 1012, 2018
2
大谷 明:ワクチン学(講談社)p. 30, 1987
資料請求先
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1
カスタマー・ケア・センター
TEL:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
FAX:0120-561-047(24時間受付)
製造販売業者等の氏名又は名称及び住所
製造販売元
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1
http://jp.gsk.com
その他の説明(付属機器の取り扱い等)
ラビピュール筋注用の使用方法
本剤は筋肉内注射用です
(1)保存時
・遮光して、2〜8℃に保存すること。
・溶剤が凍結すると容器が破損することがあるので注意すること。
(2)接種前
・混濁、着色、異物の混入、その他の異常がないかを確認し、異常を認めたものは使用しないこと。
・溶解は接種直前に行い、一度溶解したものは直ちに使用すること。
・容器の栓及びその周囲をアルコールで消毒した後、添付の溶剤で均一に溶解して、注射針をさし込み、所要量を注射器内に吸引する。
・この操作に当たっては雑菌が迷入しないよう注意する。また、栓を取り外し、あるいは他の容器に移し使用してはならない。
(3)接種時
・本剤は筋肉内注射のみに使用し、皮下注射又は静脈注射にはしないこと。
・注射針の先端が血管内に刺入していないことを確認すること。
・注射針及び注射筒は被接種者毎に取り換えること。
・本剤は、他剤と混合しないこと。
(4)注射針の選択
・針長は筋肉内接種に足る長さであるが、組織や血管あるいは骨に到達しないよう、各接種者に対して適切な針長を決定すること。
・注射針の選択に当たっては被接種者の年齢や体型を考慮すること。
(5)接種部位と接種方法
・接種部位は、通常、大腿前外側部又は上腕三角筋とし、臀部には接種しないこと。
・接種部位はアルコールで消毒し、同一部位に反復して接種することは避けること。
・筋肉内注射に当たっては、組織・神経等への影響を避けるため、神経走行部位を避けること。
・注射筒を持つ反対の手で皮膚ごと大きくつまむようにして、皮膚面に対して90°の角度で針をさす。
・注射針を刺入したとき、激痛の訴えや血液の逆流がみられた場合は直ちに針を抜き、部位をかえて注射すること。
・刺入部と同じ角度で素早く抜針する。
・年齢に応じた標準的な接種部位は以下を目安とすること注)。
1歳未満:大腿前外側部に接種する。
1歳以上、2歳未満:1歳未満児と同様、大腿前外側部または、上腕三角筋中央部に接種する。
2歳以上:上腕三角筋中央部に接種する。
三角筋上腕三角筋中央部
大腿前外側部
(大腿外側広筋)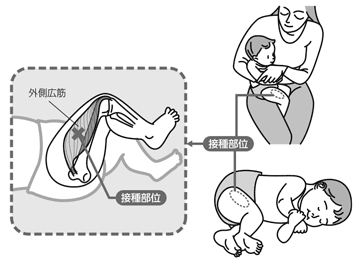
※接種の際は、太い神経の走行に注意する必要があり、確実に上図のように上腕三角筋中央部あるいは大腿外側広筋中央部に接種してください。
注)小児に対するワクチンの筋肉内接種法について(改訂版)(日本小児科学会 予防接種・感染症対策委員会)
保険適用(給付上)の注意
*本剤は狂犬病の発病阻止(曝露後免疫)の目的で使用した場合にのみ保険給付される。