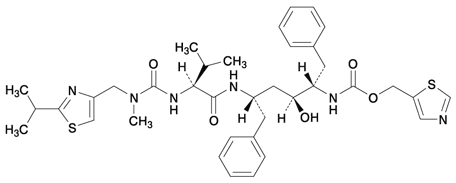
1
ノービア®錠 100mg 電子添文. アッヴィ合同会社
2
Zha J, et al.:Pharmacol Res Perspect. 2022;10(6):e01024
3
Itkonen MK, et al.:Clin Pharmacol Ther. 2019;105(1):219-228
4
カルバマゼピンとの薬物相互作用試験(2022年2月10日承認 CTD2.7.2.2.2.3.1)
5
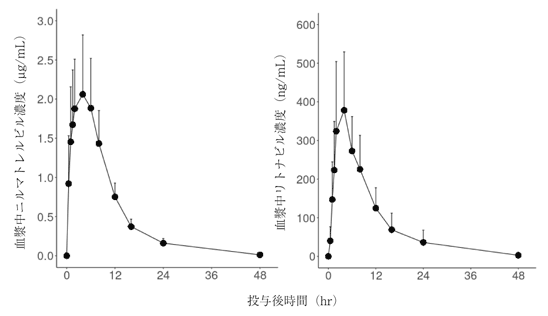
First-in-human試験PART-2:反復漸増投与(2022年2月10日承認 CTD2.7.2.2.2.1.2.2)
6
食事の影響試験(2022年2月10日承認 CTD2.7.2.2.2.2.1)
7
分布(in vitro試験)(2022年2月10日承認 CTD2.7.2.2.1.2)
8
イトラコナゾールとの薬物相互作用試験(2022年2月10日承認 CTD2.7.2.2.2.3.2)
9
代謝(in vitro試験)(2022年2月10日承認 CTD2.7.2.2.1.3)
10
First-in-human試験PART-4:代謝及び排泄(2022年2月10日承認 CTD2.7.2.2.2.1.2.4)
11
Kumar GN, et al.:J Pharmacol Exp Ther. 1996;277(1):423-431
12
腎機能障害試験(2022年2月10日承認 CTD2.7.2.2.2.5.2)
13
肝機能障害試験(2022年2月10日承認 CTD2.7.2.2.2.5.1)
14
曝露量のシミュレーション(2022年2月10日承認 CTD2.7.2.4.3.2)
15
薬物相互作用(in vitro試験)(2022年2月10日承認 CTD2.7.2.2.1.5)
16
ミダゾラムとの薬物相互作用試験(2022年2月10日承認 CTD2.7.2.2.2.4.2)
17
ダビガトランとの薬物相互作用試験(2022年2月10日承認 CTD2.7.2.2.2.4.1)
18
国際共同第Ⅱ/Ⅲ相試験[C4671005(EPIC-HR)試験](2022年2月10日承認 CTD2.7.3、CTD2.7.4、CTD2.7.6、Section 6.4.4 Efficacy Results, EUA Application. Pfizer Inc. November 2021)
19
Hammond J, et al.:N Engl J Med. 2022;386(15):1397-1408