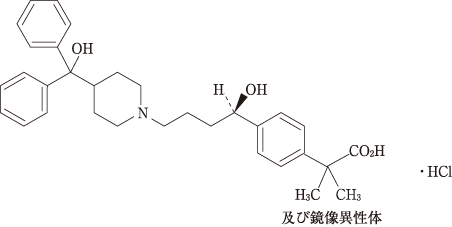
1
健康成人における薬物動態(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.1.(1))
2
生物学的同等性試験(アレグラ錠:2000年9月22日承認、申請資料概要へ.Ⅲ.4.(1))
3
小児における薬物動態(アレグラ錠:2006年10月20日承認、申請資料概要2.5.3.(2)、2.7.6.(2))
4
食事の影響(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.1.(1))
5
健康成人における蛋白結合(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅱ.2.(4))
6
健康成人における代謝(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.1.(2)、ヘ.Ⅲ.1.(3))
7
腎機能障害患者における薬物動態(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.3.(4))
8
腎機能障害における安全性の検討試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅴ.2.(2))
9
肝機能障害患者における薬物動態(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.3.(3))
10
肝機能障害における安全性の検討試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅴ.2.(3))
11
高齢者における薬物動態(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.3.(2))
12
高齢者における安全性の検討試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅴ.2.(1))
13
浦江明憲 他:臨床薬理. 2000;31(5):639-648
14
エリスロマイシンとの相互作用(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.2.(1)、ト.Ⅰ.5.(1))
15
薬物相互作用(イヌ)(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅱ.5.(3))
16
生物学的同等性試験(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.4.(2))
17
オメプラゾール及び水酸化アルミニウムゲル・水酸化マグネシウムとの相互作用(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.2.(3)、ヘ.Ⅲ.2.(4))
18
ケトコナゾールとの相互作用(アレグラ錠:2000年9月22日承認、申請資料概要ヘ.Ⅲ.2.(2))
19
Kawashima M., et al.:Int. Arch. Allergy Immunol. 2001;124(1-3):343-345
20
蕁麻疹患者における国内第Ⅲ相試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅱ.1.(1))
21
Finn A. F., et al.:J. Allergy Clin. Immunol. 1999;104(5):1071-1078
22
慢性蕁麻疹患者における海外第Ⅲ相試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅳ.1.(1))
23
季節性アレルギー鼻炎患者における用量比較試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅱ.2.(2))
24
Bernstein D. I., et al.:Ann. Allergy Asthma Immunol. 1997;79(5):443-448
25
季節性アレルギー性鼻炎患者におけるプラセボ対照二重盲検用量比較試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅳ.2.(1))
26
馬場廣太郎:耳鼻咽喉科臨床. 2007;100(2)補冊(119):1-20
27
Kawashima M., et al.:Br. J. Dermatol. 2003;148(6):1212-1221
28
中川秀己 他:西日本皮膚科. 2006;68(5):553-565
29
小児アトピー性皮膚炎患者における二重盲検比較試験(アレグラ錠:2006年10月20日承認、申請資料概要2.7.6.(2))
30
浦江明憲 他:臨床薬理. 2000;31(5):649-658
31
Tashiro M., et al.:J. Clin. Pharmacol. 2004;44(8):890-900
32
Weiler J. M., et al.:Ann. Intern. Med. 2000;132(5):354-363
33
Pratt C. M., et al.:Am. J. Cardiol. 1999;83(10):1451-1454
34
アレルギー性鼻炎における用量反応性(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅳ.2.(1))
35
Pratt C., et al.:Clin. Exp. Allergy. 1999;29(Suppl.3):212-216
36
高用量における心電図の検討試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅰ.5.(4))
37
健康成人長期投与試験(アレグラ錠:2000年9月22日承認、申請資料概要ト.Ⅴ.1.(1)、ト.Ⅴ.1.(2))
38
健康成人長期投与試験(アレグラ錠:2000年9月22日承認、申請資料概要へ.Ⅲ.3.(1))
39
QTc間隔延長の可能性に関する検討(アレグラ錠:2000年9月22日承認、申請資料概要ホ.Ⅱ.2.(1))
40
薬効薬理の検討(アレグラ錠:2000年9月22日承認、申請資料概要ホ.Ⅰ)
41
Abdelaziz M. M., et al.:J. Allergy Clin. Immunol. 1998;101(3):410-420





 01
01